И состояние репродуктивной системы женского организма в период угасания ее функции
Половое созревание и наступление менопаузы представляют собой два критических периода в жизни женщины. Первый из них характеризуется активацией, второй — прекращением функции гонад.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Как формирование, так и выключение циклической функции гонад влечет за собой целый ряд существенных изменений в нейроэндо-кринном статусе организма женщины.
Современные представления о созревании женской репродуктивной системы, о ее взаимодействии с другими системами организма рассмотрены подробно в разд. 1.4. В данном разделе мы проанализируем те процессы в репродуктивной системе, которые происходят в ходе ее угасания. Особое внимание будет уделено особенностям функционального состояния репродуктивной системы на различных ее уровнях и их взаимодействию, ибо эти знания являются основой не только адекватной диагностики и коррекции нарушений собственно репродуктивной системы в этот период, но и определения роли этой системы в возникновении ряда специфических для периода старения патологий. Все эти вопросы важны не только в теоретическом, но и в практическом отношении, так как увеличение продолжительности жизни человека, а тем самым и удлинение реального периода работоспособности, ставит перед биологией и медициной новые задачи. Согласно прогнозам ВОЗ, средняя продолжительность жизни будет возрастать и дальше [175]. Известно, что угасание функции репродуктивной системы женщины сопровождается комплексом вегетососудистых, метаболических, психоневротических и эндокринных нарушений различной степени выраженности. Общепринято считать, что эти нарушения вторичны и причиной их возникновения являются необратимые изменения состояния репродуктивной системы. Вместе с тем накопленные клинические и экспериментальные данные не позволяют считать эту проблему окончательно решенной. Очевидно, что только совершенствование представлений о физиологических параметрах функционирования репродуктивной системы во взаимодействии с другими нейроэндокринными системами в период старения организма женщины позволит разработать адекватные и эффективные пути коррекции разнообразных системных нарушений в указанный период. Наибольшей интенсивности возрастные изменения репродуктивной системы достигают в климактерический период.
Климактерический (от греч. klimakter — ступень лестницы) период — физиологический период жизни женщины, в течение которого на фоне общих возрастных изменений организма преобладают инволютивные изменения в репродуктивной системе,
1.6. Состояние репродуктивной системы в период угасания ее функции
обусловленные угасанием функции яичников. Климактерический период состоит из трех фаз: 1) пременопаузы; 2) собственно менопаузы, т.е. момента последнего менструальноподобного кровотечения; 3) постменопаузы, которая характеризуется стойким прекращением менструаций в результате потери фолликулярного аппарата яичников. Первая фаза климактерия — пременопауза — это период жизни женщины от начала снижения функции яичников до полного прекращения менструаций. Признаками ее наступления являются изменения менструального цикла, появление эмоциональной лабильности, склонности к увеличению массы тела, колебаниям АД, жара.
Обычно при характеристике женского климактерия условно выделяют перименопаузу — отрезок времени, охватывающий период примерно ± 1 год от менопаузы, наступление которой оценивается ретроспективно; перименопауза простирается на периоды пре-и постменопаузы. Именно в это время усиливаются клинические проявления, сопровождающие угасание репродуктивной функции. Нередко имеет место диссоциация между тремя возрастными категориями — хронологическим, биологическим (иногда его называют менструальным) и социальным возрастом.
Наступление постменопаузы определяют по дате последней менструации, но установление этого срока возможно только по наличию спонтанной аменореи в течение 12 мес. Постменопауза характеризуется развитием атрофических изменений в половой системе на фоне стабильно низкого уровня половых гормонов.
Наряду с традиционной трактовкой понятий, связанных с пери-менопаузальным периодом, иногда можно встретить использование термина «пременопауза» в несколько ином контексте, в частности для характеристики функционального состояния репродуктивной системы женщин после 35-летнего возраста при стабильном ритме менструаций до момента появления его нарушений. Группа экспертов ВОЗ рекомендует более конкретное использование данного термина, т.е. в первом его значении.
В современной женской популяции менопауза наступает обычно в 48—50 лет; продолжительность пременопаузы в соответствии с ее клиническими проявлениями составляет 1—2 года, а первого этапа постменопаузы, при котором сохраняется сниженная гормональная активность яичников (секреция эстрогенов), — до 3—5 лет. Вместе с тем в современных условиях продолжительность указанных этапов
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
возрастной инволюции женского организма обладает значительной индивидуальной вариабельностью, что необходимо учитывать в повседневной клинической практике, особенно при попытках трактовать патогенез различных гормонассоциированных патологических состояний репродуктивной системы. Учитывая совокупность возрастных морфофункциональных сдвигов в организме женщины и продолжительность их развития во времени, N. Utian [177] предлагает выделять в периоде климактерия три декады: ранний климактерий (35—45 лет), перименопаузальный климактерический период (46—55 лет) и поздний климактерий (56—65 лет). Более детальное изложение сопутствующих этому периоду клинико-физиологических изменений можно найти в монографии М. Л. Крымской [22].
Основной особенностью периода угасания активности репродуктивной системы женщины является изменение функции гонад. Этот возрастной процесс запрограммирован генетически заложенным в них количеством фолликулов. В яичнике плода 20-недельного гестационного возраста содержится около 7 млн ооцитов, к моменту рождения — около 1 млн, к периоду менархе — 300—400 тыс., к возрасту менопаузы — несколько сотен. В репродуктивном возрасте достигают стадии овуляции всего 300-400 ооцитов, причем в течение каждого дня этого периода происходит атрезия 30—40 фолликулов. Таким образом, старение яичника как органа, к числу основных функций которого относятся оогенез и гормонообразование, начинается с формирования женской особи и продолжается в течение всей жизни. Старение органа сопровождается тремя процессами: атрезией и/или дегенерацией фолликулов, образованием желтых тел, трансформацией различных клеточных популяций атретиче-ских и лютеиновых компонентов в клетки стромы. Известно, что средняя масса яичников начинает уменьшаться уже после 30 лет, а после 40 лет яичник женщин превращается в орган, богатый стро-мальными элементами и характеризующийся развитием в нем различного рода регрессивных процессов. На этом фоне наступление менопаузы служит клиническим маркером потери яичниками репродуктивного потенциала. Вместе с тем и в периоде перименопа-узы в яичниках нередко обнаруживаются фолликулы, находящиеся на различных стадиях развития, нередко наблюдаются мелкокистоз-ные изменения.
Литература по изучению функции яичников в климактерическом периоде обширна. Известно, что переход от характерных для
1.6. Состояние репродуктивной системы в период угасания ее функции
репродуктивной фазы регулярных менструальных циклов к аменорее сопровождается нарушениями ритма менструаций, причем продолжительность этого этапа климактерия подвержена значительным индивидуальным вариациям. Согласно данным литературы, обобщенным группой экспертов ВОЗ, в годы, предшествующие менопаузе, увеличивается частота появления ановуляторных менструальных циклов. Так, у женщин в возрасте от 26 до 40 лет число их колеблется от 3 до 7 % от общего числа циклов, тогда как между 41 и 50 годами — от 12 до 15 %. Между тем у значительной части женщин в пременопаузе сохраняются регулярные овуляторные циклы с таким же примерно уровнем стероидогенной активности фолликула и желтого тела, как и в активный репродуктивный период [132].
У женщин, вступивших в перименопаузальный период, состояние активности гонад варьирует в широком диапазоне от ову-ляторных циклов до эпизодов выключения функции яичников по постменопаузальному типу. В интервале между этими крайними ситуациями могут встречаться самые разнообразные уровни гормон-секреторной активности аденогипофиза и гонад. По клиническим и гормональным признакам период перименопаузы имеет отличия от пре- и постменопаузы. Менструальные циклы имеют склонность к большей продолжительности, нередко свыше 50 дней, однако овуляторные циклы встречаются на всех стадиях пременопаузы. Например, по данным М. G. Metcalf, R. A. Donald и J. H. Livesey [132], у 50 % женщин, находившихся под динамическим наблюдением, овуляторный цикл был зафиксирован за несколько недель до последней менструации.
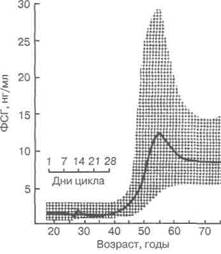
После менопаузы уровни ФСГ и ЛГ в крови возрастают в несколько раз, что связывают с постепенной утратой функции фолликулярного аппарата яичников (рис. 1.32). В период постменопаузы происходят изменения в источниках секреции циркулирующих в периферической крови половых гормонов. Концентрация Э2 резко снижается (ниже базального уровня репродуктивной фазы жизни женщины), концентрация же прогестерона сохраняется на базаль-ном уровне. Ряд исследователей описали флуктуации гонадальной активности в первые годы постменопаузы, сопровождающиеся подъемом концентрации эстрогенов в плазме крови и увеличением уровня экскреции эстрогенов с мочой. В связи с этим возникают затруднения в дифференциации по гормональному статусу непосредственно постменопаузального периода от длинных циклов в
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
|
Рис. 1.32.Возрастные изменения содержания ФСГ в плазме периферической крови (по [177])
период пременопаузы. Хотя циклическая активность репродуктивной системы в постменопаузальном периоде прекращается, это еще не означает полного прекращения процесса гормонообразования в яичниках. Известно, что в организме некоторых женщин в этом периоде отмечаются признаки эстрогенизации и уровень половых гормонов в периферической крови снижается после гонадэктомии [133]. Основным половым гормоном, образующимся в организме женщины в постменопаузе, является Э1.
В пременопаузе циркулирующие в периферическом кровотоке эстрогены имеют и яичниковое, и надпочечниковое происхождение. Образующийся в этих структурах андростендион подвергается превращениям в периферических тканях (преимущественно, в жировой ткани) в Э1 и тестостерон. До 50 % тестостерона образуется в этом возрасте за счет периферического превращения андростендиона, остальное количество гормона образуется поровну в яичниках и надпочечниках. Прогестерон образуется преимущественно в яичниках, в меньшем количестве — в надпочечниках. В перименопаузе снижается продукция эстрогенов, постепенно достигая такого уровня, который недостаточен для запуска пролиферативных процессов в эндометрии, необходимых для обеспечения менструальноподобно-го кровотечения. В постменопаузе почти полностью прекращается выработка эстрогенов фолликулярным аппаратом, но в строме
1.6. Состояние репродуктивной системы в период угасания ее функции
яичников продолжается секреция их андрогенных предшественников. Источником циркулирующего в периферическом кровотоке Э1 является преимущественная конверсия андростендиона в Э1 в жировой ткани, печени и коже. С увеличением возраста и массы тела постепенно возрастает периферическая конверсия андростендиона в Э1. Лишь очень небольшие количества Э2, обнаруживаемые у женщин в постменопаузе, образуются путем превращения непосредственно из Э1 [169]. Секреция тестостерона яичниками в постменопаузе аналогична таковой в пременопаузе, но секреция андростендиона понижена. После менопаузы 85 % андростендиона имеет надпочечниковое происхождение.
Имеются данные, что в постменопаузе с возрастом постепенно снижается секреция  -андрогенов, ДЭА и ДЭА-С, в то время как уровни
-андрогенов, ДЭА и ДЭА-С, в то время как уровни  -андрогенов, андростендиона и тестостерона не меняются [ 133]. В приложении 1 представлены возрастные уровни содержания стероидных гормонов в плазме периферической крови. Согласно полученным данным, снижение уровня тестостерона отмечается только в пери-, но не в постменопаузе.
-андрогенов, андростендиона и тестостерона не меняются [ 133]. В приложении 1 представлены возрастные уровни содержания стероидных гормонов в плазме периферической крови. Согласно полученным данным, снижение уровня тестостерона отмечается только в пери-, но не в постменопаузе.
Результаты многочисленных исследований in vitro (инкубация ткани яичников и надпочечников с различными радиоактивными субстратами) и in vivo (сочетанные исследования уровня стероидных гормонов в периферической крови и оттекающей от яичников и надпочечников крови) позволяют сделать следующие заключения:
1. В постменопаузе прогестерон и 17-ОП почти исключительно, а ДЭА преимущественно имеют надпочечниковое происхождение. Значительные количества ДЭА секретируются также яичниками.
2. Андростендион, тестостерон, дигидротестостерон имеют смешанное надпочечниково-яичниковое происхождение. В период постменопаузы яичники секретируют в периферический кровоток около 50 % тестостерона и 30 % андростендиона.
3. Эстрогены являются продуктом периферической ароматизации стероидов, секретируемых в основном корой надпочечников, но отчасти и яичниками.
4. Инкубация жировой ткани in vitro с использованием в качестве субстрата меченого андростендиона и 19 а-гидрокси-андростендиона приводит к образованию Э1, в то время как тестостерон превращается в Э2.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
5. С возрастом превращение андростендиона в Э1 прогрессирует.
Вывод об яичниковой природе определенной доли стероидных соединений, определяемых в периферическом кровотоке у женщин постменопаузального возраста, подтвержден в ряде работ. Для изучения этого вопроса обычно определяют содержание половых стероидных гормонов в артериальной и венозной крови сосудов яичников в процессе хирургических вмешательств на органах репродуктивной системы женщин, в этих же условиях используют функциональные пробы, направленные на подавление и стимуляцию надпочечников. Так, например, при комплексном обследовании 79 женщин в постменопаузе, оперированных по поводу рака матки, было установлено, что содержание Э1 и Э2 выше в оттекающей от яичников крови, чем в крови кубитальной вены. При этом выявилась положительная корреляция между этими результатами и данными морфологических исследований ткани яичников. Вместе с тем авторы не нашли различий в уровнях Э1 и суммарных эстрогенов при раке эндометрия и у больных контрольной группы, за исключением несколько более высокого уровня Э2 у больных раком. Авторы пришли к выводу, что в постменопаузе яичники способны вырабатывать как андрогенные предшественники, так и непосредственно эстрогены [99]. К аналогичным выводам приходят Nocke [134] и другие исследователи.
Результаты многочисленных работ позволяют заключить, что в постменопаузе образование Э1 не снижается, поскольку усиливается превращение андростендиона в Э1. Однако, несмотря на повышение преобразования тестостерона в Э2, данный путь стероидогенеза не играет существенной роли из-за малой его интенсивности.
Как уже указывалось, второй особенностью периода угасания репродуктивной системы является изменение уровня продукции гонадотропинов гипофизом.
В исследованиях нашей лаборатории было показано, что у женщин в пременопаузе, у которых гормональные параметры менструального цикла еще не изменены, реализация процесса фолликуло-генеза требует усиления гипофизарного сигнала — концентрация гонадотропинов в периферическом кровотоке оказывается в 2 раза выше, чем у женщин активного репродуктивного возраста, при этом концентрации ЛГ и ФСГ возрастают в равной мере. В последующие годы постменопаузы нарастание секреции гонадотропинов продолжается, причем концентрация ФСГ в периферической крови
1.6. Состояние репродуктивной системы в период угасания ее функции
повышается в 6—8 раз, а ЛГ — в 4—4,5 раза по сравнению с периодами пре- и перименопаузы. Однако были опубликованы данные, согласно которым самым ранним сигналом инволюции яичников, даже тогда, когда все еще имеется овуляция и формируется желтое тело, является повышение уровня только ФСГ в крови. Большее повышение уровня ФСГ, чем ЛГ, принято объяснять различиями в метаболическом клиренсе этих гормонов, а в последнее время — снижением секреции ингибина яичниками.
Ранее мы отметили, что у женщин для гонадотропной функции гипофиза в перименопаузе, как и для функции яичников, характерна вариабельность — от овуляторных циклов с нормальными уровнями гонадотропинов до эпизодов состояния постменопаузы с высокими концентрациями ФСГ и ЛГ. В промежутках между этими крайними ситуациями отмечаются эпизоды, редко наблюдаемые в репродуктивном периоде: подъемы уровня обоих гонадотропинов при высоких концентрациях эстрогенов в крови, кратковременные повышения уровней раздельно ЛГ и ФСГ.
Наступлению менопаузы предшествует увеличение количества случаев подъема уровня гонадотропинов до значений, характерных для постменопаузы. У женщин в постменопаузе с возрастом и длительностью периода постменопаузы степень повышения концентрации гонадотропинов в крови практически не меняется, хотя имеется тенденция к ее возрастанию в течение первых 10 лет и к снижению в последующие годы. Максимальное повышение гонадотропинов происходит уже через 3 года после менопаузы. При взятии проб крови в определенном временном интервале был показан пульсирующий характер секреции гонадотропинов с более высокой амплитудой импульсов для ФСГ по сравнению с ЛГ.
Особый интерес вызывают параметры активности других троп-ных функций гипофиза в период климактерия. По мнению ряда авторов, в постменопаузе уровень ПРЛ и ТТГ в крови понижен в сравнении с фертильным возрастом; по мере увеличения длительности постменопаузы уровень этих гормонов нарастает, а затем снижается [184, 185]. В исследованиях, проведенных в нашей лаборатории, не обнаружено достоверных различий в концентрации ПРЛ, СТГ и ТТГ у женщин в периодах пре-, пери- и постменопаузы в сравнении с женщинами активного репродуктивного периода, причем по мере увеличения длительности периода постменопаузы уровень ПРЛ, ТТГ и СТГ практически не менялся [27]. С другой стороны,
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
у экспериментальных животных показано снижение уровня СТГ в периферической крови с возрастом [174]. Вместе с тем чувствительность аденогипофиза к действию половых стероидов сохранена или несколько повышена [134]. Приводимые данные свидетельствуют о том, что повышение уровня гонадотропинов в пери- и постменопаузе не является результатом нарушения реактивности гипофиза, а лишь следствием снижения секреции половых гормонов. Высказываются предположения о том, что биологические свойства гонадотропинов в климактерии могут меняться. Не исключено, что гона-дотропины постменопаузальных женщин лишаются биологической активности в результате диссоциации их молекул на биологически неактивные субъединицы [154]. Сохраняется и чувствительность гипофиза к стимулирующему действию ГЛ. Следовательно, в генезе возрастных изменений репродуктивной системы речь может идти о возможности изменения уровня и характера гипоталамического сигнала. Действительно, ряду исследователей при определении ГЛ биологическим и радиоиммунологическим методом в крови женщин в пре- и постменопаузе удалось обнаружить концентрации этого гормона, превышающие в 2 раза таковые у молодых женщин. Однако в дальнейшем это не было подтверждено в основном из-за чрезвычайно низкой концентрации гормона в общем кровотоке.
В связи с особой ролью надпочечников в реализации специфической функции репродуктивной системы заслуживает внимания вопрос о состоянии системы гипоталамус—гипофиз—кора надпочечников в период ее старения. Литература, посвященная характеристике функционального состояния гипоталамо-гипофизарно-адреналовой системы в период угасания репродуктивной функции, не очень многочисленна. В основном имеются лишь экспериментальные данные относительно возрастных особенностей гипоталамического контроля адренокортикотропной функции гипофиза. С одной стороны, в этих исследованиях показано, что при старении снижается кортиколибериновая активность гипоталамических экстрактов. С другой стороны, при проведении функциональных проб у старых животных обнаружены инертность включения центральных регуляторных механизмов и нарушение взаимодействия (рассогласование) центрального и периферического звена гипота-ламо-гипофизарно-адреналовой системы. Адренокортикотропная функция гипофиза, тестируемая по уровню АКТГ в плазме крови, по данным ряда авторов, в пери- и постменопаузальный периоды
1 6. Состояние репродуктивной системы в период угасания ее функции
практически не меняется. Вместе с тем в литературе приводятся данные о снижении функции надпочечников с возрастом. Показано, что у людей старше 50 лет масса надпочечников достоверно снижается. Инволюция надпочечников происходит в основном за счет сетчатой и клубочковой зоны; пучковая зона, продуцирующая преимущественно глюкокортикоиды, сохраняется [10, 39].
Представления о функциональном состоянии надпочечников неоднозначны. В ряде работ имеются указания на стабильность глю-кокортикоидной функции надпочечников в возрастном аспекте; в то же время имеются данные о снижении в постменопаузе андро-генной функции надпочечников. Однако степень снижения уровня секреции отдельных андрогенов неодинакова — в большей степени снижается синтез ДЭА и ДЭА-С, в меньшей — андростендиона. A. Tolino и соавт. [175] показали, что по мере увеличения постме-нопаузального возраста (до 5 лет) уровень ДЭА-С и 17-ОП в крови достоверно возрастает, а в дальнейшем (после 5 лет) начинает снижаться. В противоположность этому D. R. Meldrum и соавт. [133] не обнаружили у женщин в постменопаузе изменений концентрации 17а-гидроксипрегненолона, 17-ОП, кортизола в крови. Одновременно авторы обнаружили достоверное снижение в крови тех же женщин концентраций ДЭА и ДЭА-С. Поскольку снижение уровня  -андрогенов имело место без соответствующих изменений содержания их предшественников, авторы исследований делают вывод о возрастных изменениях ферментативной активности (17,20-дес-молазы) в надпочечниках. Есть указания и на снижение минерало-кортикоидной функции надпочечников — уменьшение с возрастом концентраций альдостерона и активности ренина плазмы.
-андрогенов имело место без соответствующих изменений содержания их предшественников, авторы исследований делают вывод о возрастных изменениях ферментативной активности (17,20-дес-молазы) в надпочечниках. Есть указания и на снижение минерало-кортикоидной функции надпочечников — уменьшение с возрастом концентраций альдостерона и активности ренина плазмы.
Согласно результатам исследований, проведенных в НЦ АГ и П РАМН, адренокортикотропная функция гипофиза снижается у женщин в пременопаузе и, наоборот, увеличивается в пери- и постменопаузе. При этом глюкокортикоидная функция коры надпочечников оказывается сниженной только в период перименопаузы, в постменопаузе она возвращается к уровню функционирования, характерному для активного репродуктивного периода. Концентрация 17-ОП в крови в постменопаузе остается на уровне базальной секреции гормона в репродуктивном возрасте, в то время как уровень ДЭА в периферической крови женщин в постменопаузе снижен. Приводимые данные (см. прил. 1) подтверждают высказанную ранее в литературе точку зрения, опирающуюся на экспериментальные
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
исследования, о дискоординации взаимодействия центрального и периферического звена гипоталамо-гипофизарно-адреналовой системы. Итак, согласно современным данным, в периоде климактерия происходит снижение андрогенной функции надпочечников, снижение или неизменность глюкокортикоидной функции надпочечников при возрастающей или стабильной адренокортикотропной функции гипофиза, что может свидетельствовать как о дискоординации взаимодействия в системе гипоталамус—гипофиз—кора надпочечников, так и о возрастных изменениях биологических свойств АКТГ по аналогии с гипотезой, сформулированной для гонадотро-пинов постменопаузального гипофиза.
Таким образом, в противоположность периоду становления репродуктивной системы, которому предшествует фаза активации функции коры надпочечников, наступление менопаузы не связано с какими-либо заметными изменениями в системе гипоталамус—гипофиз—кора надпочечников. Скорее изменения появляются как следствие прекращения циклического функционирования гонад.
В то время как причины выключения функции гонад не требуют объяснения вследствие своей генетической заданности, представляется крайне важным и необходимым понимание процессов, являющихся следствием этого биологического феномена. Как отмечалось выше, в период постменопаузы реактивность гипотала-мо-гипофизарной оси практически не меняется. Снижение, а затем выключение функции гонад периферии по принципу обратной связи должно вести (и действительно приводит) к максимальной активности гипофиза. Возникает вопрос, чем обеспечивается и как объясняется активация гонадотропной функции гипофиза.
В последнее время определяющая роль в гипоталамической регуляции тропных функций гипофиза отводится взаимодействию трех групп биологически активных соединений: адренергическим соединениям, катехолэстрогенам, опиоидным и опиатным пептидам. Как говорилось выше, нейроны, продуцирующие эти пептиды, локализуются в той же области гипоталамуса (аркуатные ядра), где и ГЛ-нейроны, и имеют с ними тесный контакт. Общепринятой ныне точкой зрения является представление о том, что катехоламинергические вещества являются необходимыми компонентами системы стимуляции синтеза и секреции гипота-ламических факторов (либеринов). Катехолэстрогенам отводится особая роль в функционировании гипоталамуса в связи с их
1.6. Состояние репродуктивной системы в период угасания ее функции
уникальными структурными свойствами, благодаря которым эти соединения могут выступать в качестве буферной системы, меняя тем самым функциональную активность гипоталамуса (продукцию и секрецию специфических либеринов, в том числе ГЛ). В связи с этим можно предположить, что снижение секреции эстрогенов в период климактерия приводит к дефициту катехолэстрогенов, образующихся из них, повышению «адренергического» тонуса гипоталамуса и увеличению продукции ГЛ.
Поскольку гипоталамус является структурой, не только связанной с эндокринными функциями организма, но и средоточием различных центров, регулирующих вегетососудистые реакции организма, повышение его «адренергического» тонуса может стать причиной появления у женщин в пре- и постменопаузальном периодах вегетососудистой гиперреактивности и ряда других симптомов, характерных для климактерического синдрома (КС). Представляется, что осложнение физиологического течения периода возрастной инволюции репродуктивной системы КС, отличающимся от физиологического только степенью выраженности характерных для этого периода реакций организма на действие неблагоприятных факторов, является индивидуальной реакцией, связанной с особенностями состояния организма в этот период (соматического, эндокринного, психического).
Известно, что группа опиоидных и опиатных пептидов способна подавлять адренергическую активность гипоталамуса и, в конечном итоге, блокировать секрецию гонадотропинов гипофизом. В ряде работ показана эстрогенная зависимость эффективности действия опиатов, опиоидов и их блокаторов. В связи с этим можно полагать, что одним из следствий дефицита эстрогенов в постменопаузе может оказаться изменение уровня продукции этих соединений. Действительно, в плазме крови женщин в постменопаузе показано снижение концентрации в-липотропина и в-эндорфина [66, 171]. Были обнаружены различия в поведении опиоидных пептидов и АКТГ у женщин в постменопаузе. В то время как уровень опиатов и опиоидов снижается, содержание АКТГ в крови остается стабильным и уменьшается только в старости. С другой стороны, при введении опиатов отмечено блокирование выброса ЛГ [156]. Роль эстрогенов в развитии дефицита опиатов и опиоидов подтверждается тем фактом, что кастрация женщин фертильного возраста сопровождается 50 % падением уровня опиоидов в крови. Аналогичны и опубликованные
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
в литературе экспериментальные данные, согласно которым после кастрации самок Масаса rhesus в их портальной крови снижается уровень опиатов и опиоидов, а ЗГТ эстрогенами сопровождается восстановлением уровня этих соединений. Имеются данные, что в постменопаузе «опиоидный» тонус организма, оцениваемый по реакции ЛГ на действие блокатора опиоидов налоксона, нарушается или полностью исчезает. Подобным образом в условиях кастрации у женщин или экспериментальных животных не отмечается адекватной реакции со стороны лютеинизирующей функции гипофиза на введение налоксона.
ЗГТ эстрогенами у женщин со спонтанной или хирургической менопаузой либо у кастрированных животных сопровождается значительным увеличением содержания опиоидов в периферическом кровотоке и «опиоидного» тонуса ЦНС, что подтверждает концепцию о роли половых гормонов в этом феномене.
Таким образом, на фоне дефицита эстрогенов в климактерии, сопровождающегося уменьшением выработки как катехолэстро-генов, так и опиоидных и опиатных пептидов, создаются благоприятные условия для повышения «адренергического» тонуса гипоталамуса, с одной стороны, и снятия блокады гипоталамического индуктора опиатами и опиоидами — с другой, что в конечном итоге проявляется в виде гиперпродукции ГЛ и, как следствие этого, гона-дотропинов. Изложенная схема пока еще в значительной части гипотетична и требует дальнейшего углубления экспериментального и клинического анализа. Многообразные клинико-физиологические изменения, развивающиеся в организме женщины в периоде климактерия, дали возможность Utian [177] на основании собственного 20-летнего опыта изучения постменопаузы выдвинуть положение о том, что сопутствующие ей изменения функции яичников с потерей циклической гормональной активности протекают по типу истинной эндокринопатии. С точки зрения автора, критериями эндокринопатии в этих условиях являются морфологические изменения, функциональные, а также изменения в уровне гормонов, сопровождающиеся соответствующими сдвигами в состоянии гор-монозависимых органов.
Как известно, в рамках репродуктивной системы такими органами являются: вульва, влагалище, шейка и тело матки, маточные трубы, яичники; гормонозависимы также и внерепродуктивные системные структуры — молочные железы, нижние отделы моче-
1.6. Состояние репродуктивной системы в период угасания ее функции
выделительной системы. Кроме того, половые гормоны оказывают определенное влияние на ЦНС, кожу, мышцы, печень, костную ткань, сердечно-сосудистую систему. В связи с развивающимися в периоде климактерия патофизиологическими системными сдвигами возникают факторы риска развития ряда патологических состояний, являющихся следствием как дефицита эстрогенов (КС, дистрофические заболевания нижних отделов мочеполовой системы, системный остеопороз, атеросклеротические изменения сердечнососудистой системы), так и повышенной продукции половых гормонов (гиперпластические процессы и опухоли гормонозависимых органов).
К факторам риска указанных изменений, имеющих отношение к упомянутым выше состояниям избытка и дефицита гормонов, с равной степенью значимости относятся изменения липидного обмена. Возрастные изменения липидного спектра крови развиваются как у мужчин, так и у женщин (рис. 1.33), что является дополнительным доказательством протекторной роли половых гормонов. К числу довольно распространенных и постоянных признаков постменопаузы относится увеличение массы тела, с которым в определенной мере связано поддержание адекватного гормонального гомеостаза в организме женщины в переходные годы ее жизни. С другой стороны, у женщин, вступающих в период климактерия с выраженным ожирением, резко возрастает риск сердечно-сосудистой патологии. Получены
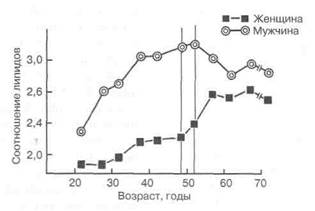
Рис. 1.33. Соотношение липидов низкой и высокой плотности у лиц различного возраста (по [102])
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
доказательства того, что при ожирении угасание функции яичников наступает заметно раньше, чем у женщин с нормальной массой тела. Согласно данным К. Klinga, Th. Hoist и В. Runnebaum [116], полученным при обследовании 186 здоровых женщин и 176 страдающих тяжелым ожирением, у женщин с ожирением и повышенным уровнем
 ФСГ климактерий наступает д на 4 года раньше.
ФСГ климактерий наступает д на 4 года раньше.
| Рис. 1.34. Антропометрические показатели (см), характеризующие нормальный женский морфотип: А — окружность грудной клетки со стандартами для 20-25 лет (а) и 45-49 лет (б); Б — длина нижних конечностей; В — рост; Г — межвертельный размер; Д — поперечный диаметр плеч |
Параллельно с повышением ФСГ отмечено преждевременное снижение уровня Э1 и Э2 и при одинаковом уровне ЛГ — пониженный уровень андростендиона в сравнении с таковым при нормальной массе тела у женщин различных возрастных категорий в пределах от 40 до 60 лет. Параллельно с увеличением массы тела отмечаются возрастные изменения типа телосложения, характеризующиеся увеличением окружности грудной клетки и межвертельного размера (рис. 1.34). В процессе общего осмотра женщины в климактерическом периоде обращают на себя внимание возрастные изменения кожных покровов, характеризующиеся истончением эпидермиса, снижением общего тургора, появлением морщин, наличием симптома «стеганого одеяла» и другими типичными признаками старения организма.
К числу наиболее типичных возрастных изменений органов репродуктивной системы непосредственно отно-
1.6. Состояние репродуктивной системы в период угасания ее функции
сятся атрофические изменения вульвы, прогрессирующее выпадение волос на лобке, истончение кожи наружных гениталий. В результате постепенного исчезновения подкожной жировой клетчатки уменьшаются большие половые губы и исчезают малые половые губы. Отсутствие эстрогенной стимуляции проявляется нарушениями процесса созревания многослойного плоского эпителия стенок влагалища, в результате чего кольпоцитограмма приобретает вначале промежуточный характер, а в последующем характеризуется преобладанием клеток парабазального типа. В результате снижения количества гликогена во влагалищном эпителии рН влагалищного содержимого возрастает до 6,0—8,0. Соответственно этому снижается сопротивляемость к микробному фактору и создаются условия для развития старческого кольпита. Влагалище становится уже и короче, происходит облитерация влагалищных сводов, потеря складчатости, может возникать диспареуния.
Уменьшаются размеры матки, масса ее снижается со 120 до 50—60 г и позже даже до 25—30 г. Слизистая тела матки истончается, железы ее становятся короткими, окружены фиброзированной стромой. Вместе с тем в течение длительного времени она сохраняет способность реагировать на эндо- и экзогенные эстрогенные влияния. Атрофия эндометрия в сочетании с олигоменореей и эпизодами аменореи обычно являются первыми клиническими проявлениями климактерия. Истончение мышечного слоя стенки шейки матки способствует тому, что граница многослойного плоского и цилиндрического эпителия в области наружного зева шейки матки как бы смещается в просвет шеечного канала и эта область перестает быть доступной для осмотра с помощью кольпоскопа. Маточные трубы после менопаузы находятся в состоянии покоя, их мышечный слой и слизистая претерпевают те же изменения, что и тело матки. Размеры яичников уменьшаются, они сохраняют характерную неровную поверхность. У женщин в постменопаузе возрастает число урологических симптомов. Особой подверженностью к изменениям атрофического характера отличается дистальная часть уретры, вследствие которых могут образовываться структуры с последующей обструктивной цистопатией и накоплением остаточной мочи. В целом наиболее характерными признаками локальных возрастных изменений в органах репродуктивной системы являются нарушения биологических барьеров и подверженность в связи с этим различным бактериальным и вирусным инвазиям. Этому способствуют

 Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
атрофия наружных гениталий, зияние половой щели и опущение стенок влагалища, снижение защитных способностей влагалищного эпителия и барьерных функций содержимого влагалища. Тело матки приобретает срединное положение вследствие потери тонуса дном матки и ослабления связочного аппарата; в этих условиях резко возрастает подвижность матки и ее неустойчивость не только к чрезмерным, но и к повседневным физическим напряжениям и усилиям. Этому способствуют также и атрофические изменения со стороны поддерживающего аппарата половых органов в области промежности и тазового дна.
Изложение материалов, касающихся характеристики состояния репродуктивной системы в период угасания ее функции, целесообразно завершить рассмотрением конкретных данных об особенностях течения климактерия в современных условиях на примере одного из регионов нашей страны. Так, исследования Э. И. Сле-пышевой и Г. А. Лопыриной [38] в сравнении с опубликованными Е. М. Вихляевой в 1966 г. данными, а также данными других авторов, показали отчетливую тенденцию к удлинению репродуктивного периода и более позднему наступлению климактерия и менопаузы за 25-летний промежуток времени, разделяющий исследованные женские популяции.
В этом исследовании изучение возрастных границ и особенностей течения физиологического климактерия проведено в популяции 749 женщин 45-58 лет с помощью специальной квалификационной шкалы. Свидетельством начал климактерия является комплекс психоэмоциональных, вегетососудистых изменений, нарушений менструальной функции и возрастной инволюции половых органов. Для определения периода, соответствующего окончанию климактерия, служили такие признаки, как стойкое прекращение менструальной функции, выявление выраженной атрофии половых органов, уменьшения размеров матки и стабильного (на протяжении 3—4 мес.) атрофи-ческого типа кольпоцитограммы, а также исчезновение психоэмоциональной и вегетососудистой симптоматики. Несмотря на известную схематичность подобной оценки при довольно широком диапазоне индивидуальных характеристик возрастной инволюции женского организма в современных условиях, подобный подход дает возможность уловить общие тенденции в характеристике этого процесса.
Согласно полученным данным, физиологическое течение климактерия имеет место у 60 % представительниц изученной со-
1.6. Состояние репродуктивной системы в период угасания ее функции
временной популяции. При осложненном его течении у 52,3% женщин выявлены признаки КС различной степени тяжести, у 34,2% — дисфункциональные маточные кровотечения, у 14,6% обследованных — сочетание этих симптомокомплексов. Тяжелое течение осложненного климактерического периода требовало стационарного лечения у 9,8 % из общего контингента обследованных. При обследовании женщин с физиологическим течением климактерического периода было установлено, что началу климактерия соответствовал возраст 49,6 ± 0,2 лет, наступлению менопаузы — 51,4 ± 0,3 года, средняя продолжительность периода регулярных менструальных циклов — 38,2 ± 0,4 лет, длительность климактерического периода — 3,3 ± 0,8 года. Авторами отмечена частота двух клинических вариантов физиологического течения климактерия. У 1\3 женщин на фоне прогрессирующего нарастания гипоэстроге-нии наблюдался плавный переход от нормального менструального цикла к гипоменструалъному синдрому и наступлению менопаузы в возрасте до 50 лет. У 2/3 женщин менструальноподобные кровотечения приобретали на фоне гиперэстрогении ациклический характер с периодами кратковременного восстановления циклических менструаций, склонностью к развитию гиперпластических изменений в эндометрии, более позднему наступлению менопаузы.
Из числа локальных признаков возрастной инволюции репродуктивной системы наиболее ранними, появляющимися в начале пременопаузы, являются уменьшение интенсивности оволосения в области лобка, снижение тургора тканей и утончение кожи половых губ. Следующими по времени появления и частоте признаками являются уменьшение размеров матки, сужение наружного зева, уплощение сводов влагалища. Эти изменения у половины женщин появляются в пременопаузе и, как правило, почти у каждой женщины отмечаются спустя 2 года после менопаузы.
Несмотря на то что продолжительность периода гормональной активности яичников детерминирована генетически, различные факторы могут оказывать влияние как на время наступления менопаузы, так и на особенности течения различных фаз климактерического периода. Это и общий соматический статус, и условия труда и быта, и особенности питания, и климатогеографические условия. Необходимо, кроме того, отметить, что у женщин, выкуривающих более 1 пачки сигарет в день, менопауза наступает в среднем почти на 1,5 года раньше, чем у некурящих.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
При преждевременном наступлении менопаузы, куда, в соответствии с современными представлениями, относят случаи прекращения менструальной функции у женщин 38—43 лет, климактерический период приобретает тяжелое течение. Частота преждевременного климакса в современных популяциях колеблется от 1,4 до 12,5%.
Психологические реакции на наступление климактерия протекают неоднозначно. У каждой пятой (20 %) женщины имеет место пассивная реакция с принятием его как неизбежности; у 15 % реакция имеет невротический характер и протекает в виде своеобразного сопротивления с нежеланием принимать происходящие изменения, при этом преобладает, как правило, нейропсихическая симптоматика; у 10 % женщин развивается повышение социальной активности, возникает критическое отношение к жалобам сверстниц. Адекватная реакция с постепенным приспособлением к возрастным нейро-гормональным реакциям организма отмечается у 55 % вступающих в период климактерия женщин.
Литература
1. Анашкина Г. А. Гормональные параметры овуляторного менструального цикла женщины в норме и при некоторых формах нарушений репродуктивной функции: Автореф. дис. ... канд. мед. наук. — М., 1984.
2. Атлас сканирующей электронной микроскопии клеток, тканей и органов / Под ред. О. В. Волковой, В. А. Шахламова, А. А. Миронова. — М.: Медицина, 1987. — С. 385-435.
3. Бабичев В. Н. Нейрогормональная регуляция овариального цикла. — М.: Медицина, 1984. — 238 с.
4. Беляева Л. А. «Система канальцев» в железистом эпителии и ее клиническое значение // Акуш. и гин. — 1984. — № 5. — С. 5-8.
5. Беляева Л. А., Бухвалов И. Б., Железное Б. И. и др. Влияние про-гестинов на ультраструктуру клеток эндометрия при его предо-пухолевых изменениях и раке (исследование органной культуры) // Архив пат. — 1982. — № 44. — Вып. 4. — С. 5-12.
6. Богданова Е. Н. Эмоциональный стресс как причина вторичной аменореи у девушек // Акуш. и гин. — 1981. — № 7. — С. 6—8.
Литература
7. Волкова О. В., Малиновский М. С. Матка // БМЭ. — 3-е изд. — 1980. — № 13. — С. 476-480.
8. Волкова О. В. Функциональная морфология женской репродуктивной системы. — М.: Медицина, 1983. — 224 с.
9. Вундер П. А. Эндокринология пола. — М.: Медицина, 1980.
10. Гинекологическая эндокринология / Под ред. К Н. Жмакина. — М.: Медицина, 1980.
11. Глуховец Б. И., Лебедев С. С, Рязанцев Е. Л. Значение сосудистых нарушений в патогенезе хронического сальпингита // Акуш. и гин. — 1983. — № 9. — С. 67-68.
12. Глуховец Б. И., Ухов Ю. П., Лебедев С. С. и др. Гормонально-обусловленные реакции эпителия эндосальпинкса // Арх. анат., гистол. и эмбриол. — 1983. — № 85. — Вып. 7. — С. 72-78.
13. Ежова Л. С, Железное Б. И., Антипова Н. Б. Влияние внутри-маточных контрацептивов на митотический режим эндометрия //Акуш. и гин. — 1980. — № 3. — С. 39-40.
14. Железное Б. И. Принципы гистологической диагностики патологии эндометрия // Акуш. и гин. — 1978. — № 1. — С. 68—73.
15. Железное Б. И. Принципы гистологической диагностики патологии яичников и маточных труб // Акуш. и гин. — 1978. — № 10. — С. 67-71.
16. Железное Б. И., Беляева Л. А. Изменения пролиферативных процессов эндометрия под влиянием прогестерона и норэтисте-рона в условиях органной культуры // Акуш. и гин. — 1980. — № 3. — С. 32-35.
17. Железное Б. И., Беляева Л. А., Бухвалов И. Б. и др. Ультраструктура и электронно-гистохимические свойства железистого эпителия эндометрия женщины // Арх. анат., гистол. и эмбриол. — 1986. — № 91. — Вып. 8. — С. 65-75.
18. Жуковский М. А., Лебедев Н. Б., Семичева Т. В. и др. Нарушения полового развития. — М.: Медицина, 1989. — 272 с.
19. Кобозева Н. В., Гуркин Ю. А. Перинатальная эндокринология. — Л.: Медицина, 1986. — 312 с.
20. Кобозева Н. В., Кузнецова М. Н., Гуркин Ю. А. Гинекология детей и подростков. — Л.: Медицина, 1988. — 293 с.
21. Кондриков Н. И. Патофизиологические особенности маточных труб // Акуш. и гин. — 1989. — № 2. — С. 38-44.
22. Крымская М. Л. Климактерический период. — М.: Медицина, 1989. — 271 с.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
23. Куперт А. Ф. Эпителий экто- и эндоцервикса в онтогенезе // Акуш. и гин. — 1981. — № 6. — С. 18-21.
24. ЛичкоА. Е. Подростковая психиатрия. —Л.: Медицина, 1985. — 416 с.
25. Лукин В. А. Исследование катехоламинов и активности моно-аминоксидазы в эндометрии на протяжении менструального цикла // Акуш. и гин. — 1975. — № 12. — С. 22-24.
26. Международный симпозиум по возрастной периодизации / Матер, симпозиума. — М., 1965. — 31 с.
27. Методы оценки эндокринной функции репродуктивной системы // Сб. науч. трудов ВНИЦ ОЗМР СССР / Под ред. Н. Д. Фонченко. — М., 1986. — 200 с.
28. Мицкевич М. С. Гормональная регуляция в онтогенезе животных. — М.: Наука, 1979. — 156 с.
29. Нарушения репродуктивной системы в период детства и полового созревания // Сб. трудов ВНИЦ ОЗМР МЗ СССР / Под ред. М. П. Кузнецовой. — М., 1986.
30. Персианинов Л. С, Железное Б. П., Богоявленская П. В. Физиология и патология сократительной деятельности матки. — М.: Медицина, 1975. — С. 5-80.
31. Петрова Е. П. Гистологическая диагностика заболеваний матки. — М.: Медицина, 1964. — 172 с.
32. Покровский В. А., Козаченко В. П. и др. Дисплазии и внутри-эпителиальная карцинома шейки матки. — М.: Медицина, 1970. — 245 с.
33. Прянишников В. А. Функционально-морфологическая модель организации эпителия нормального, гиперплазированного и опухолевого эндометрия человека // Арх. пат. — 1979. — №41. —Вып. 1. —С. 60-66.
34. Резников А. Г. Половые гормоны и дифференциация мозга. — Киев: Наука, 1982.
35. Розен В. Б., Смирнов А. П. Рецепторы и стероидные гормоны. — М.: Изд-во МГУ, 1981. — 309 с.
36. Селезнева Н. Д., Железное Б. И. Доброкачественные опухоли яичников. — М.: Медицина, 1982. — 287 с.
37. Серов В. Н. Послеродовые нейроэндокринные заболевания. — М.: Медицина, 1978. — 246 с.
38. Слепышева Э. П., Лопырина Г. А. Современные особенности климактерия у женщин // Акуш. и гин. — 1986. — № 5. — С. 38-40.
Литература
39. Сметник В. П., Ткаченко Н., М., Глезер Г. А., Москаленко Н. П. Климактерический синдром. — М.: Медицина, 1988. — 285 с.
40. Толчиева О. И., Прянишников В. А., Жемкова 3. П. Биопсия эндометрия. — М.: Медицина, 1978. — 232 с.
41. Торганова И. Г., Коханский И. Н., Адамян Л. В. и др. Множественный корреляционный анализ зависимости между содержанием половых гормонов в периферической крови, фолликулярной жидкости и размерами фолликула // Пробл. эндокри-нол. — 1984. — № 2. — С. 30-34.
42. Уланова Л. Н., Володина Н. Н., Жаховская Р. И. и др. О стандартизации показателей полового созревания детей и подростков // Педиатрия. — 1981. — № 4. — С. 70-72.
43. Фонченко Н. Д., Алексеева М. Л., Щедрина Р. Н., Новиков Е. А. Некоторые функциональные характеристики репродуктивной системы самки зеленой мартышки // Акуш. и гин. — 1986. — № 3. — С. 68-70.
44. ХаррисонД., Уайнер Д., ТэннерД. и др. Биология человека: Пер. с англ. — М.: Мир, 1979. — 611 с.
45. ХэмА., КормакД. Гистология: Пер. с англ. — М.: Мир, 1983. — Т. 5. — 296 с.
46. Шахламова М. Н. Морфофункциональные и цитологические особенности эндоцервикса при применении оральных контрацептивов // Акуш. и гин. — 1988. — № 8. — С. 50-54.
47. Щедрина Р. Н., Стурчак С. В., Боброва Е. Г. и др. Изучение специфичности эстрадиолсвязывающей системы маток морских свинок // Бюл. экспер. биол. мед. — 1976, 83. — № 8. — С. 989-993.
48. Щедрина Р. Н., Минина Л. Изучение особенностей связывания ряда эстрогенов с эстрогенрецепторными системами гипота-ламо-гипофизарных структур морских свинок // Бюл. экспер. биол. мед. — 1980, 54. — № 10. — С. 478-480.
49. Яковлева И. Л., Черный А. П. и др. Эпителий шейки матки в процессе малигнизации. — Кишинев: Штиинца, 1981. — 128 с.
50. Amendt P., Rohde W., Dormer G. Alters-undgeschltchts-abhangige Serum Konzentratiftnen von LH, FSH una Prolaktin in Kinde-salter // Dtsch. Gesundheitswes. — 1983. — Vol. 38. — № 15. — P. 577-583.
51. ApterD., Vinko R. Serumpregnenolone, progesterone, 17a-hydroxy-progesterone, testosterone and 5a-dihydrotestosterone during female puberty // J. clin. Endocr. — 1977. — Vol. 45. — P. 1039-1042.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
52. Apter D., Pakarinen A., Vihko R., Hammond G. L. Adrenocrotical function in puberty, serum АСГН, Cortisol and dehydroepiandroster-one in girls and boys // Acta paediat. scand. — 1979. — Vol. 68. — P. 420-423.
53. Backstrom C, McNetttyA., Leask R. et al. Pulsatile secretion of LH, FSH, prolactin, oestradiol and progesterone during the human menstrual cycle // Clin. Endocrinol. — 1982. — Vol. 17. — P. 29-42.
54. Baggish S., Pauerstein C, Woodruff J. Role of stroma in the regeneration of the endometrial epithehum // Amer. J. Obstet. Gynecol. — 1967. — Vol. 98. — P. 459-465.
55. Baird D. Factors regulating the growth of the preovulatory follicle in the sheep and human // J. Reprod. Fertil. — 1983. — Vol. 69. — P. 343-352.
56. Bayard ¥., Damilano S., Robel P. et al. Cytoplasmic and nuclear estradiol and progesterone receptors in human endometrium // J. clin. Endocr. — 1978. — Vol. 46. — № 4. — P. 635-648.
57. Baker E. Body weight and the initiation of puberty // Clin. Obstet. Gynecol. — 1985. — Vol. 28. — № 3. — P. 573-579.
58. Bergman K. S., Schwaizberg S. D., Harris В. Н. Pregnancy following repair of vaginal atresia // J. pediat. Surg. — 1988. — Vol. 23. — №11. —P. 1063-1064.
59. Bond J., Robinson G, Farmer S. Differential expression of two neutral cell-specific (3-tubulin mRNAs during rat brain development // Molec. cell Biol. — 1984. — Vol. 4. — P. 1313-1327.
60. Bouchard P., Lagoggicy M., Brailly S. et al. Gonadotropin-releasing hormone pulsatile administration restores LH pulsatility and normal testosterone levels in males with hyperprolactinemia // Endocrin. Matabol. — 1985. — Vol. 60. — № 2. — P. 258-262.
61. Branchard C, Goodyer C, Refebere J. Functional zonation of the human fetal adrenal cortex pathways of Cortisol synthesis in the fetal and definitive zones // J. Steroid Biochem. — 1984. — Vol. 20. — № 6B. — P. 1424.
62. Buttman V. Mullerian anomalies and their management // Fertil. and Sterh. — 1983. — Vol. 40. — № 2. — P. 159-163.
63. Carmel P., Araki S., Ferin M. Pituitary stalk blood collection in rhesus monkeys: evidence for pulsatile release of gonadotropin-releasing hormone (GHRH) // Endocrinology. — 1976. — Vol. 99. — P. 243.
Литература
64. Carr В. R., Parker С. R., Simpson E. R. The regulation of cholesterol metabolism in the human fetus // J. Steroid Biochem. — 1984. — Vol. 20. — № 6B. — P. 1415.
65. Casper R., Yen S. Simultaneous pulsatile release of prolactin and luteinizing hormone-releasing factor agonist // J. clin. Endocr. — 1981. —Vol. 51. —P. 934.
66. Casper R. F., Yen S. С. С. Neuroendocrinology of menopausal flushes, a hypothesis of flush mechanisms // J. clin. Endocr. — 1985. — Vol. 23. — № 3. — P. 293-312.
67. Chappel S. C, Ulloa-Agurre A., Ramaley J. Sexual maturation in female rats: time-related changes in the isoelectric focusing pattern of anterior pituitary follicle-stimulating hormone // Biol. Reprod. — 1983. — Vol. 28. — № 1. — P. 198-205.
68. Check Y, Rankin A., Techman M. The risk of fetal anomalies as a result of progesterone therapy during pregnancy // Fertil. and Ste-ril. — 1986. — Vol. 45. — № 3/4. — P. 575-577.
69. Claugh R., Radrigues-Siers J. Synaptic changes in the hypothalamus of the prepubertal female rat administered estrogen. // Amer. J. Anat. — 1983. — Vol. 167. — P. 205-211.
70. Clark S., Ellis N., Styne D. et al. Hormone ontogeny in the ovine fetal demonstration of pulsatile luteinizing hormone secretion by the fetal pituitary // Endocrinology. — 1984. — Vol. 115. — P. 1774-1777.
71. Clarke J., Cummings J. The temporal relationship between gonado-tropin-releasing hormone (GnRH) and luteinizing hormone (LH) secretion in ovariectomized ewes // Endocrinology. — 1982. — Vol. 111. —P. 1737.
72. Clarke J., Cummings J. Increased GnRH pulse frequency associated with estrogen-induced LH surge in ovariectomized ewes // Endocrinology. — 1985. — Vol. 116. — P. 2376-2381.
73. Clyman M. A new structure observed in the nucleoulus of the human endometrial epithelial cell // Amer. J. Obstet. Gynecol. — 1963. — Vol. 86. — № 4. — P. 430-432.
74. Corley K., Valk Т., Kelch R., Marshall Jr. Estimation of GnRH pulse amplitude during pubertal development // Pediat. Res. — 1981. — Vol. 15. — P. 157-161.
75. Crowley W., Fillicori M., Spratt D. et al. The physiology of gonado-tropin-releasing hormone (Secretion in men and women) // Recent Progr. Hormone Res. — 1985. — Vol. 41. — P. 473-480.
' Вихляева Е. M.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
76. Dallenbach F., Vonderlin D. The innervation of the human endometrium //Arch. Gynak. — 1973. — Bd. 215. — P. 365-376.
77. Dallenbach-Hettweg G. Endometrium. Pathologische Histologic in Diagnostik und Forschung. Zweite Aufl. — Heidelberg — New York, 1981.— 351 p.
78. Diagnosis and treatment of fertility/ Eds. P. Rowl, E. Vikhlyaewa.— Toronto: Hans Huber Publ., 1985.
79. Dierschke D., Attacharya A., Atkinson L. et al. Circhoral oscillations of plasma LH levels in the ovariectomized monkey // Endocrinology. — 1970. — Vol. 87. — P. 850-853.
80. Dubrauszky V., Pohlmann G. Strukturveranderungen am Nucleolus von Korpusendometriumzellen wahrend der Sekretionsphase // Naturwissenschaft. — 1960. — Bd. 47. — P. 523-524.
81. Elkind-Hirsch K., Ravnikar U., SchiffL. et al. Determination of endogenous immununoreactive luteinizing hormone-releasing hormone in human plasma // J. clin. Endocr. — 1982. — Vol. 54. — P. 600-602.
82. Elkind-Hirsch K., Platia M., SchiffL. Elevation of plasma immu-noreactive LH-RH in hyperprolactinemiac-amenorrheic women on bromocryptine therapy // J. Reprod. Med. — 1987. — Vol. 32. — № 1. — P. 5-9.
83. Endocrinology and physiology of reproduction / Ed. P. Leung et al. — New York — London: Plenum Press, 1987. P. 23.
84. Endocrinology and physiology of reproduction / Eds. P. Leung, D. Armstrong, K. Ruf, W. Aoger. — New York and London: Plenum Press, 1987. — 359 p.
85. Endocrine rhythms / Ed. D. T. Krieger. — New York: Raven Press,
1979. — P. 143.
86. Endocrinology of human infertility: New aspects / Ed. P. G. Crosig-nani, B. L. Rubin. — London: Academic Press. — 1981. — 306 p.
87. Episodic Hormone Secretion (from Basic Science to Clinical Application) / Eds. T. Wagner, M. Filicori. — Hamelin: TM-Verlag, 1987. — 260 p.
88. Espey L. Ovulation as an inflammation reaction // Biol. Reprod. —
1980. — Vol. 22. — № 1. — P. 73-107.
89. Evans E., Baskevritch P., Rocherford H. Estrogen-receptor-DNA
activation. Difference between activation by estrogen and anti-
estrogen // Europ. J. Biochem. — 1982. — Vol. 128. — № 1. —
P. 185-191.
Литература
90. Ferin M., Dyrenfurth L., Cowchock S. et al. Active immunization to 17p-estradiol and its effects upon the reproductive cycle of the rhesus monkey // Endocrinology. — 1974. — Vol. 94. — P. 765-776.
91. Ferin M., Van Vugt D., Wardeaw S. The hypothalamic control of the menstrual cycle and the role of endogenous opioid peptides // Recent Progr. Hormone Res. — 1984. — Vol. 40. — P. 441-456.
92. Ferruhn V. Die Ektopie in der neugeborenen Periode. Bine vaginosko-pische Studie // Geburtsh. u. Frauenheilk. — 1979. — Bd. 39. — № 7. — P. 568-573.
93. Fritz M., Speroff R. The endocrinology of the menstrual cycle: the interaction of folliculogenesis and neuroendocrine mechanisms // Fertil. and Steril. — 1982. — Vol. 38. — № 5. — P. 509-529.
94. Fritz M., Speroff R. Current concepts of the endocrine characteristics of normal menstrual function: the key to diagnosis and management of menstrual disorders //Clin. Obstet. Gynec. — 1983. —Vol. 26. — № 3. — P. 647-689.
95. Gambacciani M., Liu J., Swartz W. et al. Intrinsic pulsatility of luteinizing hormone from the human pituitary in vitro // Neuroendo-crinology. — 1987. — Vol. 45. — P. 402-406.
96. Genazzani A., Petralgia F., Facchinetti F. et al. Puberty and body weight: the role of circulating opioids // J. Steroid Biochem. — 1984. — Vol. 20. — P. 1426-1430.
97. Genazzani A., Facchinetti F., Petralgia F. et al. Correlations between plasma levels of opioid peptides and adrenal androgens in prepuberty and puberty // J. Steroid Biochem. — 1989. — Vol. 19. — № 1. — P. 891-895.
98. The Gonadotropins: Basic science and clinical aspects in females. — London — New York: Academic Press, 1982.
99. Gronros M., Ktemi P., Salmi Т., Rauramp L., Punnonen R. Ovarian production of estrogens in postmenopausal women // Int. J. Gynec. Obstet. — 1980. — Vol. 18. — № 2. — P. 93-98.
100. Hafez E. Structural and ultrastractural parameters of the cervix // Obstet. Gynecol. Survey. — 1982. — Vol. 37. — № 6. — P. 507-506.
101. Haus E., Lakatua D., Halberg F. et al. Chronobiological studies of plasma prolactin in women in Kyushu, Japan, and Minnesota, USA // J. clin. Endocr. — 1980. — Vol. 51. — P. 632-636.
102. Heiss G., Tamir J., Davis C. et al. Lipoprotein-cholesterol distributions in selected North American populations // Circulation. — 1980. — № 1. — P. 302-315.
7* 195
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
103. Hodgen G. The dominant ovarian follicle // Fertil, and Steril. — 1982. — Vol. 38. — № 5. — P. 281-300.
104. HoffJ., Lasley В., Wang C. et at. The two pools of pituitary gonado-tropin-regulation during the menstrual cycle // J. Clin. Metab. — 1977. — Vol. 44. — P. 302-312.
105. Hoffman A., Crowley W. Induction of puberty in men by long-term pulsatile administration of low-dose gonadotropin-releasing hormone // New Engl. J. Med. — 1982. — Vol. 307. — P. 1237-1243.
106. Honore L., O'Hara K. Ovarian hilus cell heterotopia // Obstet. and Gynec. — 1979. — Vol. 53. — № 4. — P. 561-564.
107. Hormones and Breast Cancer / Ed. M. С Piko, P. K. Silters, C. N. Welsh. — New York: Banbury Report & Cold Spring Harbor Laboratory. — 1981. — 262 p.
108. Jakackl R., Kelch R., Sander S. et al. Pulsatile-secretion of luteinizing hormone in children // J. clin. Endocr. — 1982. — Vol. 55. — P. 453-458.
109. Janne O., Kontlla K, Vlnko R. Progestin receptors in human tissues: concentrations and finding kinetics // J. Steroid Biochem. — 1976. — Vol. 7. — № 11/12. — P. 1061-1068.
110. Johnson M., Everitt B. Essential Reproduction. — Oxford, London, Edinburgh, Boston, Melbourne: Blackwell Scientific Publication, 1984. — 367 p.
111. Jungblut P., Heklm N. Mayer H. et al. Subcellular distribution, properties and interrelationship of oestrogen receptors in endometrium and other target tissues // J. Clin. Chem. Clin. Biochem. — 1983. — Vol. 21. — P. 473-480.
112. Kaufman J., Kesner J., Wilson R. et al. Electrophysiological manifestation of LHRH pulse generator activity in the rhesus monkey: influence of alpha-adrenergic and dopaminergic blocking agents // Endocrinology. — 1985. — Vol. 116. — P. 1327-1331.
113. Kelch R., Hopwood N, Sauder S. et al. Evidence for decreased secretion of gonadotropin-releasing hormone (GnRH) in pubertal boys during short term testosterone treatment // Pediat. Res. — 1985. — Vol. 19.— P. 112-117.
114. Kesner J. S., Kaufman J. M., Wilson R. С et al. The effect of morphine on the electrophysiological activity of the hypothalamic luteinizing hormone releasing hormone pulse generator in the rhesus monkey // Neuroendocrinology. — 1986. — Vol. 43. — P. 686-691.
Литература
115. King R. Structure and function of steroid receptors // J. Endocr. — 1987. — Vol. 114. — № 3. — P. 341-343.
116. Klinga K, Hoist Th., Runnebaum B. Influence of severe obesity on peripheral hormone concentrations in pre- and postmenopausal women // Europ. J. Obstet. Gynec. — 1983. — Vol. 15. — № 2. — P. 103-112.
117. Knobil E., Plant Т., Wildt L. et al. Control of the rhesus monkey menstrual cycle: permissive role of hypothalamic gonadotropin-rele-asing hormone // Science. — 1980. — Vol. 207. — P. 1371-1375.
118. Knobil E. The neuroendocrine control of the menstrual cycle // Recent Progr. Hormone Res. — 1980. — Vol. 36. — P. 53-88.
119. Korenman S. Relation between estrogen inhibitory activity and binding to cytosol of rabbit and human uterus // Endocrinology. — 1970. — Vol. 87. — № 8. — P. 1119-1112.
120. Lenasi H., Hudnik-Plevnik R., Rakar J. et al. Distribution of progesterone receptors between the cytosol and nuclear fraction in normal and neoplastic human endometrium // J. Steroid Boichem. — 1987. — Vol. 26. — № 4. — P. 457-463.
121. Lenton E., Sulaiman R., Soborvale O. et al. The human menstrual cycle plasma concentrations of prolactin, LH, FSH, oestradiol and progesterone in conceiving and non-conceiving women // J. Reprod. Fertil. — 1982. — Vol. 65. — № 1. — P. 131-139.
122. Leyendecker G., Struve Т., Plotz C. Induction of ovulation with chronic intermittent (pu
Дата добавления: 2016-07-09; просмотров: 1900;
