Нейрогуморальная регуляция и состояние репродуктивной системы в период ее активного функционирования
Последнее двадцатилетие отмечено значительными достижениями в анализе механизмов эндокринного контроля менструального цикла женщины. Многочисленные клинические и экспериментальные исследования дали возможность существенно расширить представления об основных закономерностях процессов роста фолликула, овуляции и развития желтого тела, охарактеризовать особенности гонадотропной и гипоталамической регуляции этих процессов. Полученные данные в совокупности с результатами изучения секреции половых и гонадотропных гормонов в динамике менструального цикла послужили основой для создания стройной концепции о системе взаимосвязей, обеспечивающих циклическую активность репродуктивной системы женщины.
Для общей характеристики функционирования репродуктивной системы хотелось бы вернуться к аналогии, предложенной классиками репродуктивной эндокринологии [53, 155], которые сравнили
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
деятельность репродуктивной системы с игрой оркестра, в котором роль дирижера выполняют гонады. На основе полученных нами новых данных, а также анализа данных литературы к этому можно было бы добавить, что, поскольку ведущие музыканты оркестра играют на электроинструментах, для исполнения программы необходим не только дирижер, но и источник питания инструментов — переменный ток. Более простой аналогией может служить обычный телевизор, внутри которого (в черном ящике) происходят прием, переработка и выдача сигналов, однако необходимым условием его работы является питание от сети током определенной частоты и напряжения. Изменение же параметров тока, как известно, приводит к тому, что совершенно исправный телевизор может дать искаженное изображение или вообще перестать работать. Выявление природы «источника питания» — пульсирующего выброса ГЛ — позволило не только получить новые представления о патогенезе нарушений репродуктивной функции, но и поставить вопрос о механизмах и сроках формирования «черного ящика», т.е. всей репродуктивной системы в целом.
Соответственно этим представлениям до последнего времени было принято считать, что как у низших млекопитающих, так и у человека секреция гонадотропных гормонов находится под контролем двух центров в гипоталамусе — циклического, расположенного в преоптической области промежуточного мозга, и ациклического (тонического) — в аркуатной зоне. Клетки тонического центра, се-кретирующие гонадотропин-рилизинг гормон — ГнРГ (люлиберин, или гонадолиберин), специфически воспринимают ингибирующее влияние половых гормонов и тем самым определяют базальный уровень секреции гонадотропинов у особей как мужского, так и женского пола. Циклический же центр, функционирующий только у женских особей, способен принимать стимулирующие эффекты Э2 и обеспечивает овуляторный выброс гонадотропных гормонов. Однако в течение последнего десятилетия эта традиционная концепция была существенно пересмотрена на основе новых клинико-экспе-риментальных данных. Этому в значительной мере способствовало внедрение в экспериментальные исследования новых методических приемов, а также совершенствование способов определения пептидных гормонов, и в частности ГЛ, как в периферической крови, так и в портальной системе гипофиза.
Переоценка старых понятий также связана со сменой объекта исследований в эксперименте. Так, в последние годы в крупных
1.5. Состояние репродуктивной системы в период ее активного функционирования
исследовательских центрах в качестве экспериментальной модели все чаще используют низших обезьян Старого и Нового Света (главным образом, Масаса rhesus), временные и количественные характеристики менструального цикла которых наиболее близки к человеку. Оказалось, что регуляция менструального цикла у обезьян существенно отличается от регуляции астрального цикла у грызунов (крыса, кролик, морская свинка) [118, 150]. Переход от исследований на низших млекопитающих к приматам в значительной мере способствовал разработке основных положений современной концепции гипоталамо-гипофизарно-гонадальных взаимосвязей.
Первый камень в фундамент новой концепции был заложен открытием периодической флуктуации (или, как ее называют, пульсации) уровня ЛГ в периферической крови Масаса rhesus [79]. Поскольку подъем уровня ЛГ наблюдается приблизительно 1 раз в час, обнаруженное явление было названо цирхоральным ритмом секреции ЛГ. Цирхоральный ритм секреции гонадотропинов был выявлен также у грызунов, птиц, овец, телят и у человека [71, ПО].
Успехи в изучений природы и регуляции пульсации гонадотропинов и современное состояние теории нейроэндокринного контроля менструального цикла связаны в основном с работами лабораторий Е. Knobil и Ferin в США, которые подробно рассмотрены в разд. 1.1. В ряде экспериментальных и клинических работ было показано, что в норме частота и амплитуда импульсов гонадотропинов существенно меняется в зависимости от фазы менструального цикла, причем при сопоставлении пульсаций ЛГ и ФСГ в течение всего цикла у женщины и астрального цикла у животных (крыса, корова, обезьяна) выявлена их полная идентичность [53, 87, ПО]. W. Crowley и соавт. [75] приводят результаты, полученные в 62 нормальных овуляторных циклах у женщин репродуктивного возраста, у которых кровь для исследования гормонов брали с 10-минутными интервалами в течение 24 ч в разные фазы цикла. Было установлено, что в ранней и средней фолликулиновой фазе частота импульсов ЛГ близка к цирхоральной. По мере нарастания уровня 17в-эстрадиола в крови отмечено снижение амплитуды импульсов гонадотропинов до 3—4 мМЕ/мл. По достижении определенного критического уровня секреции Э2 авторы наблюдали кратковременное, но четко выраженное увеличение частоты и амплитуды импульсных выбросов ЛГ и ФСГ; непосредственно после овуляции происходит восстановление цирхорального ритма пульсации гонадотропных гормонов. Об-
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
разование желтого тела и увеличение секреции прогестерона меняли характер пульсации ЛГ и ФСГ: снижение частоты импульсов ЛГ до 5—6, а позднее до 2—3 в течение суток сопровождалось увеличением их амплитуды в 4—10 раз по сравнению со средней фолли-кулиновой фазой. При этом пульсация гонадотропинов приобрела бимодальный характер: после каждого высокого пика ЛГ следовало несколько пиков с малой амплитудой. Такой характер пульсации ЛГ определяется, скорее всего, угнетающим действием прогестерона на секреторную активность аркуатного осциллятора. Приведенные данные о значительном колебании уровня гонадотропинов в крови (в особенности в лютеиновую фазу) необходимо учитывать при исследовании ЛГ и ФСГ в диагностических целях. Они объясняют также неоднозначность данных, получаемых разными авторами при 1—2-разовом определении гормонов в крови.
В настоящее время не вызывает сомнения тот факт, что циклическое выделение гонадотропных гормонов, наблюдаемое на протяжении репродуктивного периода жизни женщины, определяется гормонами яичника. Данные многих исследователей позволили прийти к заключению, что точкой приложения действия половых гормонов является как гипоталамус, так и (преимущественно) гипофиз. Влияние гормонов яичника опосредуется через механизмы отрицательной и положительной обратных связей, временные и количественные параметры которых подробно изучены. Известно, что созревание доминантного фолликула из примордиального — процесс, зависящий от ФСГ. По мере увеличения секреции Э2 доминантным фолликулом усиливается (по механизму отрицательной обратной связи) торможение секреторной функции аденогипофиза. При достижении критического уровня Э2 проявляется его кратковременный стимулирующий эффект на секрецию гонадотропинов, обусловливающий выброс ЛГ (в меньшей степени — ФСГ) и последующую овуляцию. После образования желтого тела проявляется совместный угнетающий эффект Э2 и прогестерона на секрецию гонадотропинов. По мере снижения секреторной функции желтого тела в поздней лютеиновой фазе уровень гонадотропных гормонов в крови постепенно возрастает вплоть до наступления следующего цикла.
Таким образом, гормоны яичников регулируют процессы, протекающие не только в самом яичнике, но и в гипоталамо-гипофизар-ном комплексе через механизмы отрицательных и положительных
1.5. Состояние репродуктивной системы в период ее активного функционирования
обратных связей, временные и количественные параметры которых изложены в работах [93, 94].
17Р-эстрадиол является у приматов основным гормоном, уча
ствующим в обеспечении функциональных связей между отдельны
ми звеньями репродуктивной системы. Нейтрализация 17в-эстради-
ола в крови у обезьян введением антисыворотки к нему приводит к
нарушению циклической активности репродуктивной системы [90].
Увеличение концентрации 17в-эстрадиола в крови предшествует
активации секреции ЛГ и играет важную роль в реализации его пре-
довуляторного выброса. Насколько велика роль Э2 в поддержании
циклической секреции ФСГ, пока остается неясным, поскольку по
вышение содержания ФСГ можно расценивать и как сопутствующее
увеличение ЛГ в результате воздействия общего рилизинг-фактора
(гонадолиберина).
К настоящему времени получены новые данные о механизмах, обусловливающих предовуляторный выброс ЛГ. Если раньше считалось, что этому предшествует активация секреции ГЛ, то с помощью современных методов установлено, что у приматов, в отличие от животных с астральным циклом, центр циклической секреции гонадотропинов отсутствует [150]. Показано, что как у обезьян, так и у человека выделение ГЛ из гипоталамуса происходит в виде импульсов. Характер изменений частоты импульсов и их амплитуды на протяжении менструального цикла еще обсуждается [53]. Известно, однако, что постоянное введение одной и той же дозы ГЛ (в режиме 1 инъекция/90 мин) обезьянам с поврежденным гипоталамусом, у которых нет эндогенного ГЛ, индуцирует восстановление менструального цикла, не отличающегося от спонтанного [90]. Введение ГЛ в таком же режиме женщинам с гипоталамической формой аменореи приводит к созреванию фолликула, овуляции и формированию полноценного желтого тела [122, 123]. В зависимости от характера и степени нарушений в ритмическом выделении ГЛ у женщин могут наблюдаться ановуляция, олигоменорея, недостаточность желтого тела, аменорея, причем все эти явления можно рассматривать как стадии одного патологического процесса [123]. Аналогичные события, но в обратном порядке происходят в процессе становления менструальной функции у девочек, когда постепенная стабилизация выделения ГЛ вначале обусловливает появление олигоменореи, затем ановуляторных циклов с недостаточностью лютеиновой фазы и только затем — нормальных циклов.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Таким образом, можно полагать, что в регуляции менструального цикла гипоталамус осуществляет роль пермиссивного механизма, тогда как регуляция циклической секреции гонадотропинов контролируется преимущественно на гипофизарном уровне содержанием Э2 (и прогестерона) в периферическом кровотоке. В ряде работ было показано, что ЛГ (а возможно, и ФСГ) присутствует в гипофизе в виде двух пулов — легко освобождаемого и резервного [93, 104]. Предполагается, что соотношение обоих пулов регулируется как гормонами яичника, так и самим ГЛ посредством самостимулирующего эффекта, развивающегося под влиянием Э2. На протяжении менструального цикла прослеживается динамическое изменение соотношения обоих пулов гонадотропинов [104], что рассматривается авторами как существенно важный элемент механизма, определяющего циклический выброс гонадотропинов.
Роль других гормонов яичника в поддержании циклического ритма образования гонадотропинов у приматов нельзя считать окончательно выясненной. В экспериментах на обезьянах и в серии клинических исследований установлено, что прогестерон только в сочетании с Э2 способен вызывать изменения секреции гонадотропинов [117,118]. Эффект прогестерона может быть стимулирующим или тормозящим в зависимости от его содержания в крови, эстро-генной насыщенности организма и характера временных сочетаний его взаимодействия с эстрогенным компонентом. В литературе широко обсуждается вопрос о роли ПРЛ и гиперпролактинемии в регуляции фертильности.
В экспериментах, проведенных в лаборатории Knobil, перевязка ножки гипофиза у крыс и разрушение аркуатных ядер гипоталамуса сопровождались резким повышением уровня ПРЛ в периферической крови — до 500 нг/мл (при норме — 20 нг/мл). Вместе с тем это не являлось препятствием для индукции у этих животных при импульсном введении ГЛ. Имеются данные о снижении ритма импульсного выделения ГЛ при всех типах гиперпролактинемии. Однако снижение уровня ПРЛ у женщин, получающих парлодел по поводу гиперпролактинемии, не оказывает влияния на характер пульсации гонадотропинов [88, 183]. Импульсное введение ГЛ было также применено у 4 мужчин с пролактиномами [60]. На фоне лечения отмечалась нормализация ритма секреции гонадотропинов, их уровня и уровня тестостерона, тогда как содержание ПРЛ в крови повышалось в еще большей степени. Авторы пришли к заключе-
1.5. Состояние репродуктивной системы в период ее активного функционирования
нию, что непосредственной причиной гипогонадизма у больных с гиперпролактинемией является недостаточность ГЛ, сопровождаемая увеличением секреции ПРЛ. Приведенные результаты подтверждает и Leendecker, которому удалось индуцировать овуляцию у женщин с пролактиномой с помощью импульсного введения ГЛ [122]. В описанном им случае лечение ГЛ привело к нормализации уровней гонадотропинов и Э2 в крови на фоне высоких значений ПРЛ и овуляция наступила в те же сроки, что и у пациенток, имеющих нормальный уровень ПРЛ.
Таким образом, имеются основания считать, что в описанных случаях основной причиной аменореи и гипогонадизма у больных с гиперпролактинемией являлась недостаточность ГЛ.
Экспериментальные и клинические данные о взаимном влиянии ГЛ и ПРЛ многочисленны и противоречивы. Несомненно, что недостаточность функции аркуатного осциллятора прямо или косвенно влияет на секрецию ПРЛ [126], тогда как существование обратного эффекта на функции гипоталамуса еще требует подтверждения. К настоящему времени представления о механизмах регуляции репродуктивной системы существенно расширились. Было показано, что секреция ФСГ контролируется не только половыми гормонами, но и белковыми факторами — прежде всего ингибинами А и В [78]. Каждый из ингибинов состоит из двух полипептидных субъединиц — аив. Ингибин А сформирован из общей а-субъединицы и специфичной для него [З-А-субъединицы, а ингибин В — из а- и в-В-субъединиц. Первый секретируется преимущественно желтым телом, а второй — растущими полостными фолликулами.
Физиологическая роль ингибинов заключается в торможении аденогипофизарной секреции ФСГ. По мере роста доминантного фолликула содержание ингибина В в крови начинает прогрессивно увеличиваться, в результате чего снижается секреция ФСГ и тем самым предотвращается новая волна фолликулогенеза. Ингибин А, активно секретируемый желтым телом, обеспечивает дополнительную блокаду синтеза ФСГ.
Поскольку концентрация ингибинов в крови зависит от числа фолликулов в яичнике, в лабораторной практике определение ингибинов широко используется для оценки «овариального резерва» — количества фолликулов, способных отвечать на стимуляцию гонадотропинами.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Постоянно развиваются представления об участии в регуляции менструального цикла и таких соединений, как опиаты (эндорфин, энкефалины, динофрин). Они синтезируются в гипофизе, гипоталамусе и во многих органах и тканях (гонады, плацента, легкие, ЖКТ).
Эстрадиол усиливает секрецию опиатов, а они в свою очередь снижают частоту пульсов ГЛ. Таким образом эндогенные опиаты угнетают секрецию гонадотропинов, воздействуя на гипоталамиче-ский центр, синтезирующий ЛГ.
В заключение следует отметить, что открытие аркуатного осциллятора в гипоталамусе и его роли в репродуктивной функции человека позволило объяснить нарушения этой функции при ряде патологических состояний, связанных с поражениями ЦНС, в стрес-сорных ситуациях, при лактации и т.д.
В физиологических условиях аркуатная область гипоталамуса служит, по-видимому, интегратором, воспринимающим и куму-лирующим как высшие нейронные сигналы, так и влияние гонад и других эндокринных желез, переводя «нервный сигнал на язык эндокринной системы» [3, 118]. Афферентная информация в виде нервного импульса воспринимается аркуатным осциллятором и реализуется в виде изменения ритма его секреторной активности. Примером могут служить стрессорные ситуации. При их устранении или при искусственном наведении ритма секреции ГЛ могут наблюдаться восстановление цирхоральной пульсации гонадотропинов и нормализация деятельности репродуктивной системы. Так, например, введение ГЛ в импульсном режиме больным с нервной анорексией способствует восстановлению менструального цикла, несмотря на продолжающуюся потерю массы тела [87].
Появление в начале 1960-х гг. принципиально новых методов количественного определения гормонов повлекло за собой интенсивное изучение динамики секреции гонадотропных и половых гормонов на протяжении менструального цикла женщины. Полученные данные послужили основанием для выявления объективных критериев нормы, т.е. такого состояния репродуктивной системы, при котором возможна реализация генеративной функции [94, 155]. Вместе с тем по мере расширения исследований, посвященных изучению эндокринного профиля менструального цикла, выяснилось, что наличие нормальной продукции гормонов не всегда оказывается свидетельством сохранности репродуктивной функции [1, 90, 118],
1.5. Состояние репродуктивной системы в период ее активного функционирования
так что далеко не каждый цикл является фертильным. Отсюда возникает вопрос о значении информации, получаемой при оценке гормональных параметров периферической крови, а именно: позволяют ли эти данные судить о готовности всей репродуктивной системы к реализации генеративной функции? Возникает предположение, что нормальные значения этих параметров свидетельствуют лишь о сохранности овуляции и характеризуют функциональную активность органов, обеспечивающих ее осуществление.
Изучение гормональных параметров менструального цикла здоровых женщин показало следующее. Средние значения базальной секреции ЛГ на протяжении обеих фаз цикла сохраняются практически на постоянном уровне и не превышают 10 МЕ/л, амплитуда ову-ляторного пика составляет 39,5 МЕ/л (от 30,9 до 50,5). Содержание ФСГ начинает возрастать в конце предыдущего цикла и удерживается на высоком уровне до «-7» дня (колебания от 4,0 до 10,0 МЕ/л), после чего временно снижается и затем вновь повышается одновременно с пиком ЛГ до значения 9,5 (7,4—14,1) МЕ/л. В последующем до «+9» дня наблюдается снижение уровня ФСГ, за которым следует очередное возрастание базальной секреции гормона.
Секреция Э2 характеризуется двухфазным увеличением. Прогрессирующее нарастание уровня гормона в фолликулиновой фазе длится в среднем 5 дней и достигает максимума за день до пика содержания ЛГ — 1152 (986—1335) пмоль/л. В лютеиновой фазе секреция Э2 увеличивается до значений, приблизительно вдвое меньших предовуляторного пика. Секреция прогестерона достоверно увеличивается в день пика ЛГ и непрерывно возрастает до «+8» дня, достигая значения 28,0 (24,0—33,0) нмоль/л.
Следует подчеркнуть, что, согласно полученным нами данным, процесс овуляции в индивидуальных циклах протекал при значительно различающихся уровнях секреции гормонов. Так, значения пиков циклической секреции как ЛГ, так и ФСГ различались в отдельных наблюдениях почти в 5 раз, а их отношения колебались от 0,8 до 3,4. Значения предовуляторного пика секреции Э2 колебались от 900 до 2000 пмоль/л. Содержание Э2 и прогестерона в плазме периферической крови в период расцвета желтого тела различалось в 7 и 5 раз соответственно, а отношение прогестерон/эстрадиол колебалось в этот период от 34,5 до 170,3.
Можно полагать, что количественные параметры секреции гормонов не являются определяющими в системе эндокринного
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
контроля процесса овуляции. Подтверждением этого могут служить результаты изучения секреции гормонов в циклах с искусственно измененными гормональными параметрами. Так, например, в циклах, индуцированных пергоналом при гипогонадотропной аменорее, показатели секреции гормонов, сопровождавшие процесс овуляции, не обнаруживают количественных закономерностей не только в циклах разных пациенток, но и в повторных лечебных циклах у одной и той же женщины; кроме того, не выявлено значимых различий в уровнях продукции гормонов в циклах, завершившихся беременностью (фертильных) и не завершившихся ею.
Возможность реализации полноценной овуляции при резком изменении уровня секреции гонадотропинов свидетельствует в пользу широко признаваемого в настоящее время положения о том, что ритмический характер активности репродуктивной системы определяется яичником. Гонадотропная функция гипофиза, находящаяся под множественным контролем факторов внутренней и внешней среды и, кроме того, обладающая собственным ритмом активности, оказывается гораздо более лабильной, нежели функция яичников. Определенная независимость процесса фолликулогенеза от гона-дотропной стимуляции является, по-видимому, эволюционно обусловленной, поскольку яичник представляет собой физиологически более древний орган по сравнению с центральными структурами.
В отличие от количественных характеристик, временные параметры секреции гормонов характеризуются большей стабильностью. Примечательно, например, что длительность предовуляторного нарастания уровня Э2 в отдельных циклах, как спонтанных, так и индуцированных пергоналом, колеблется в узких пределах (4—6 дней, в среднем 5,5 ± 0,3 дня), причем продолжительность этого периода не зависит от общей продолжительности фолликулиновой фазы цикла. Более того, этот период остается постоянным и при значительных изменениях длительности циклов на фоне приема норэтистерона. Предовуляторный максимум концентрации Э2 в наибольшем количестве циклов прослеживается за день или в день пика ЛГ, тогда как первое достоверное возрастание секреции прогестерона отмечается в день пика ЛГ [1].
На основании сказанного выше можно выдвинуть ряд предположений по вопросу о принципах функциональной организации репродуктивной системы женщины — вопросу, который и на сегодняшний день остается открытым. По-видимому, в основе этой ор-
1.5. Состояние репродуктивной системы в период ее активного функционирования
ганизации лежат не количественные, а временные факторы. Одним из наиболее вероятных принципов функциональной организации репродуктивной системы является стохастический. Известно, что сконструированные по данному принципу саморегулирующиеся системы обладают очень высокой прочностью, и неслучайно, что при попытках разработать математические модели менструального цикла был использован именно стохастический подход. Определенная неадекватность ряда разрабатываемых моделей связана, скорее всего, с абсолютизацией количественных управляющих параметров, что приводит к ограничению их применимости для описания ряда конкретных ситуаций. Существование пороговых значений продукции гормонов, необходимых для реализации циклической активности репродуктивной системы, не может рассматриваться как факт, противоречащий сформулированному выше положению. Действительно, указанные параметры могут, с одной стороны, расцениваться как триггерные элементы, а с другой — как показатели, характеризующие деятельность отдельных звеньев репродуктивной системы.
Последнее предположение нашло обоснование в исследованиях, посвященных выяснению источника половых гормонов в периферической крови [41]. С помощью многофакторного корреляционного анализа различных параметров, характеризующих рост и созревание доминантного фолликула, в сопоставлении с уровнем половых гормонов в периферической крови удалось подтвердить гипотезу, выдвинутую рядом авторов [55, 131], о наличии двух тканевых структур, синтезирующих Э2 в развивающемся фолликуле. Исходя из этой гипотезы, можно принять, что клетки теки способны как продуцировать андрогены, так и ароматизировать их до эстрогенов. Ткань теки фолликула хорошо васкуляризована, и образующийся Э2, не попадая во внутреннюю среду фолликула, поступает непосредственно в кровяное русло. В то же время васкуляризован-ные клетки гранулезы продуцируют прогестерон и ароматизируют поступающие к ним от теки андрогены; их продукция аккумулируется в фолликулярной жидкости и не поступает в периферический кровоток. Однако в данном контексте практически отсутствует информация о внутренней среде фолликула — фолликулярной жидкости и самого объекта овуляции — яйцеклетки.
В связи с этим особый интерес представляют данные о гормональных параметрах периферической крови в сопоставлении с гор-
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
мональным составом фолликулярной жидкости и морфологическим состоянием ооцитов, аспирированных из доминантного фолликула. В отдельных наблюдениях выявлено, что на фоне предовулятор-ных значений Э2 в периферической крови в фолликулярной жидкости концентрация гормона была низкой и присутствовал ооцит с признаками явной дегенерации. В других случаях при низких концентрациях половых гормонов в фолликулярной жидкости обнаруживался полноценный ооцит, а при высоком уровне гормонов находили ооцит, носящий явные признаки дегенерации. При этом гормональные параметры крови соответствовали предовуляторным показателям. Сказанное выше позволяет предположить определенную разобщенность двух функций фолликула: эндокринной, заключающейся в выработке половых стероидных гормонов, которым принадлежит интегрирующая роль в деятельности всей репродуктивной системы, и собственно репродуктивной функции. Таким образом, понятия нормальный и фертильный менструальный цикл неравнозначны. Понятие фертильного цикла должно включать в себя наличие нормальных гормональных параметров крови, необходимых для функционирования всей репродуктивной системы, и выхождение в процессе овуляции полноценной яйцеклетки. Учитывая известную зависимость между продукцией гормонов и состоянием органов-мишеней, можно предположить, что при интактности всех звеньев системы реализация репродуктивной функции более вероятна в циклах с нормальными гормональными показателями. В то же время нормальная продукция гормонов не служит гарантией активности системы, оптимальной для наступления беременности. Вследствие многокомпонентности репродуктивной системы сохранение синхронности всех процессов, обеспечивающих ее функциональную целостность, является лишь вероятностным событием. В связи с этим правильнее рассматривать гормональные параметры менструального цикла как характеристики циклической деятельности репродуктивной системы и функциональной активности ее компонентов.
Одним из элементов, определяющих реализацию репродуктивной функции женского организма, является состояние специфического акцептора тканей органов-мишеней — рецепторного аппарата, осуществляющего реализацию действия гормонов, вырабатываемых элементами репродуктивной системы. Исследования по изучению субклеточных процессов, происходящих в гормоно-
1.5. Состояние репродуктивной системы в период ее активного функционирования
зависимых тканях-мишенях репродуктивной системы под влиянием экзо- и эндогенных гормонов, послужили основой для нового этапа развития репродуктивной эндокринологии. На первых порах накапливались данные о механизме действия пептидных и стероидных гормонов на субклеточные структуры органов и тканей репродуктивной системы — фундаментальные аспекты проблемы, которые позволили получить реальное представление о внутриклеточных процессах, инициируемых этими гормонами и обеспечивающих их специфический эффект (рис. 1.30).
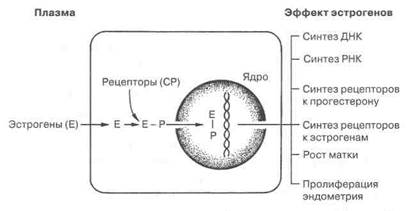
Рис. 1.30. Механизм действия эстрогенов
Так, было установлено, что механизм действия пептидных гормонов на клеточном уровне состоит в их связывании с рецепторами, расположенными на мембране клетки, последующем влиянии на процессы в цитозоле и ядре клетки до возникновения опосредованного эффекта. В противоположность этому местный эффект стероидных гормонов реализуется путем пассивной диффузии их в клетки организма. Они проникают в любые клетки организма, задерживаясь лишь в клетках гормоночувствительных тканей, где образуют комплексы с цитозольными рецепторами с последующей транслокаций в ядро клетки и воздействием на генетический аппарат. Таким путем реализуется эффект на уровне генетического кода клетки — специфический эффект, свойственный данной ткани. Исследования этого процесса опубликованы во многих оригинальных и обобщающих работах последнего десятилетия [36].
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Многочисленные исследования посвящены изучению внутриклеточного распределения эстрадиол- и прогестерон-рецепторных систем эндометрия матки женщины. Так, группой авторов была проделана серия работ, посвященных изучению внутриклеточного распределения рецепторов стероидных гормонов в клетках эндометрия. В работе Е Bayard и соавт. [56] приводятся данные о содержании рецепторов эстрогенов и гестагенов в цитоплазматической и ядерной фракциях клеток эндометрия в ходе менструального цикла (определение методом лигандного обмена). Показано, что максимальный уровень рецепторов Э2 и прогестерона приходится на пе-риовуляторный период и в дальнейшем постепенно снижается к концу менструального цикла. При этом к началу лютеиновой фазы в цитозоле происходит более резкое снижение уровня рецепторов, чем в ядерной фракции. К концу цикла вдвое снижается уровень ядерных рецепторов Э2, причем в фолликулиновой фазе цикла наблюдается превалирование цитозольной фракции над ядерной, а в лютеиновую — наоборот. Что касается рецепторов прогестерона, то превалирование уровня их цитоплазматической фракции над ядерной наблюдается в течение всего цикла, кроме начала лютеиновой фазы, когда связывающие места в указанных компонентах клетки распределены равномерно. Суммарное количество рецепторов прогестерона больше, чем Э2, на протяжении всего цикла, за исключением начала пролиферативной фазы.
P. Robel и соавт. [160] приводят сравнительные данные о внутриклеточном распределении рецепторов эстрогенов и прогестерона в динамике нормального овуляторного цикла и соответствующие данные для ановуляторных циклов и циклов с недостаточной лютеиновой фазой. Авторы обнаружили, что содержание ядерных рецепторов эстрогенов, а следовательно, отношение уровней рецепторов в цитозольной и ядерной фракциях, в эндометрии женщины с недостаточностью лютеиновой фазы существенно отличается от значений, характеризующих нормальный овуляторный цикл вне зависимости от его фазы. Что касается уровня рецепторов прогестерона в цитозоле и ядрах эндометрия при данной патологии, то он соответствует таковому в начале лютеиновой фазы. В ановуляторных циклах авторы обнаружили увеличение доли ядерных рецепторов Э2 и снижение ядерных рецепторов прогестерона по сравнению с показателями предовуляторного периода. Полученные в Научном Центре акушерства и гинекологии РАМН данные по характеристике уровня стероидных рецепторов не-
1.5. Состояние репродуктивной системы в период ее активного функционирования
сколько отличаются от изложенных в предыдущей работе [47], что, по-видимому, обусловлено различиями как в подборе обследованных пациенток, так и в методах измерения рецепторов стероидных гормонов в ядрах клеток эндометрия. Более поздние сведения о внутриклеточном распределении рецепторов эстрогенов, представленные P. Jungblut и соавт. [111], указывают на то, что более половины рецепторов внеядерной локализации ассоциированы с цитоплазматиче-скими структурами, в основном с шероховатым эндоплазматическим ретикулумом. Авторы связывают выявленную локализацию с местом синтеза рецепторов женских половых гормонов.
При интерпретации данных, приводимых различными исследователями, об уровнях рецепторов стероидных гормонов в ткани эндометрия, следует иметь в виду, что соответствующие значения могут различаться в зависимости от участка эндометрия, из которого получена ткань для исследования. Так, например, D. Robertson и соавт. [161] и J. Tsibris и соавт. [176] показали, что концентрация стероидных рецепторов в эндометрии снижается от дна матки по направлению к каналу шейки. F. Bayard и соавт. [56] также отмечают различия в концентрации рецепторов стероидных гормонов в слизистой различных отделов матки, однако, по их наблюдениям, эти различия не носят систематического характера. Соотношение же между уровнями содержания рецепторов Э2 и прогестерона остается постоянным вне зависимости от локализации биоптата эндометрия. В рамках данного исследования авторы отметили также высокую положительную корреляцию между уровнем содержания Э2 в плазме крови и концентрацией рецепторов эстрогенов в эндометрии в фолликулиновой фазе цикла. Вместе с тем между концентрацией прогестерона в крови и концентрацией цитозольных рецепторов женских половых гормонов была обнаружена отрицательная корреляция [135], хотя A. Sevey и соавт. [168] отмечают низкий уровень значимости этих корреляций.
Измерение содержания Э2 и прогестерона в ткани эндометрия в течение менструального цикла выявило, что в пролиферирующем эндометрии содержится около 1 нг эстрадиола и от 2 до 9 нг прогестерона на 1 г ткани, в то время как в стадии секреции количество Э2 в эндометрии снижается в два раза, а прогестерона, наоборот, возрастает 3—4 раза. Данные, полученные J. Poortman и соавт. [152] по внутриклеточному распределению Э2 в эндометрии, свидетельствуют о превалировании Э2 в ядерной фракции независимо от фазы
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
цикла. При этом максимальный уровень Э2 приходится на периову-ляторный период — 0,9 и 2,5 нг/г ткани в цитозольной и ядерной фракциях соответственно. К концу секреторной фазы цикла внутриклеточное содержание Э2 достигает минимума.
Приведенные выше данные дают возможность сформулировать следующие представления о состоянии эстрадиол- и прогестерон-рецепторных систем эндометрия в динамике нормального овулятор-ного цикла. Повышение уровня рецепторов Э2 в предовуляторном периоде соответствует выбросу в периферический кровоток, что обусловливает повышение синтеза рецепторов в цитоплазме и ядерную транслокацию гормон-рецепторных комплексов. Одновременно возрастает концентрация цитоплазматических рецепторов прогестерона, индуцируемых Э2 [36, 109]. Постовуляторное снижение внутриклеточного содержания рецепторов Э2 является следствием повышения уровня прогестерона. Соответственно снижается эстро-гензависимый синтез ПР и прогестерон сам тормозит синтез своих собственных рецепторов [36]. Вместе с тем непосредственно после овуляции снижается только количество цитоплазматических рецепторных мест, тогда как концентрация рецепторов прогестерона в ядрах повышается, возможно, в связи с транспортом гормон-рецеп-торных комплексов в ядра [120]. По данным ряда авторов, в течение менструального цикла концентрация рецепторов Э2 и прогестерона в ядрах не превышает таковую в цитоплазме, так как уровень обоих гормонов в эндометрии ниже необходимого для насыщения рецепторных мест. Соответственно, большая доля рецепторов остается незанятой и локализуется в цитоплазме.
Понятен интерес к определению содержания рецепторов половых гормонов в клинико-диагностических целях при ановуля-торных циклах, недостаточности лютеиновой фазы, гиперплазии эндометрия [138]. Высокий риск развития гиперплазии эндометрия и аденокарциномы у женщин с ановуляторными циклами может быть обусловлен несдерживаемой и пролонгированной секрецией Э2, что создает основу для накопления в высокой концентрации ядерных эстроген-рецепторных комплексов и формирует повышенную чувствительность и восприимчивость к эстрогенным влияниям. Результаты многочисленных исследований показали также, что указанные общие свойства рецепторных систем репродуктивной системы женщины сохраняются на протяжении большей части жизни, в том числе после угасания гормональной активности яичников.
1.5. Состояние репродуктивной системы в период ее активного функционирования
Любопытные данные получены при сравнительном изучении эстроген-рецепторных систем органов-мишеней человека. Установлено, что рецепторные системы матки и маточных труб женщины имеют ряд общих свойств: в обоих случаях взаимодействие гормона с рецептором осуществляется в основном посредством водородных связей; специфичность стероид-рецепторного взаимодействия определяется преимущественно природой кольца А стероидной молекулы. Указанные свойства присущи аналогичным рецепторным системам, выделенным из тканей животных разных видов [ 119]. В то же время имеют место и четкие различия между рецепторами матки и труб. Так, несмотря на принципиально общий характер специфичности исследованных систем, выявлена достоверная разница в их сродстве к одним и тем же стероидам. Кроме того, было показано, что вклады идентичных функциональных групп стероидной молекулы во взаимодействие с рецепторными системами слизистой матки и маточных труб значительно различаются между собой. Все это позволяет сделать вывод о неидентичности активных центров рецепторных систем разных органов-мишеней. Представляется, что этот вывод достаточно обоснован. Действительно, Э2 в различных органах-мишенях вызывает биологические ответы, характерные для данного органа, но не равнозначные между собой.
В эндометрии под действием Э2 происходит активная пролиферация, в яйцеводах млекопитающих — стимуляция секреторной активности, в яйцеводах птиц — активация синтеза белков яйца [36]. Изменения, возникающие под влиянием этого гормона в эстроген-чувствительных ядрах гипоталамуса, имеют значительные качественные особенности [138]. Очевидно, в каждом отдельном случае происходит активация различных участков генетического аппарата, что указывает на присутствие тканеспецифичных эстроген-рецепторных комплексов. В последние годы были обнаружены два класса эстроген-рецепторных систем — а и (3, различающиеся по локализации и специфичности.
Положение о неидентичности рецепторных систем различных органов-мишеней открывает практические перспективы направленного воздействия на определенные звенья репродуктивной системы. К сожалению, возможность изучения соответствующих свойств рецепторных систем мозга человека отсутствует. Вместе с тем сведения такого рода крайне необходимы в связи с широким распространением в клинической практике гормональных препара-
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
тов с выраженной центральной активностью. Для изучения особенностей действия подобных препаратов на гормонозависимые ткани репродуктивной системы необходимы исследования на адекватных экспериментальных моделях. Выбор подобной модели для изучения специфического эффекта эстрогенов весьма затруднителен вследствие значительных видовых различий. Обычные лабораторные животные (мыши, крысы, кролики) не подходят для этих целей, так как специфичность их эстрадиол-рецепторных систем принципиально отличается от таковой у человека [119]. В нашей лаборатории эндокринологии при проведении подобных исследований в качестве модельного животного была использована морская свинка. Выбор модели определялся прежде всего характером эстрального цикла у этих животных, характеризующегося спонтанной овуляцией и длительной лютеиновой фазой. По указанным параметрам морские свинки в большей степени, чем другие лабораторные животные, сходны с человеком; кроме того, принципиальные закономерности эстрадиол-рецепторного взаимодействия в матке и яйцеводах морских свинок аналогичны таковым в соответствующих органах-мишенях человека.
В рамках проведенных исследований у морских свинок были обнаружены выраженные различия свойств рецепторных систем матки и яйцеводов. Как и у человека, константа ассоциации Э2 с рецепторами слизистой матки оказалась выше, чем с рецепторами яйцеводов. Существенно различается также специфичность обоих систем у морских свинок. При сравнении специфичности эстрадиол-рецепторных систем гипофиза и переднего гипоталамуса морских свинок [29] выявились, как и предполагалось, отличия этих систем как друг от друга, так и от систем периферических органов-мишеней. Таким образом, было получено подтверждение тому, что тканевая специфичность эстрадиол-рецепторных систем является биологической закономерностью.
Представляется, что специфика указанных систем находит объяснение с эволюционной точки зрения. Как известно, первые позвоночные появились около 500 млн лет назад в Кембрии. В последующем ходе эволюции у них возникли эстроген-чувствительные органы репродуктивной системы. Согласно представлениям одного из ведущих эволюционных эндокринологов Barrington, эволюция эндокринной системы могла осуществляться несколькими путями, а именно: 1) с возникновением новых функций возникла
1.5. Состояние репродуктивной системы в период ее активного функционирования
способность к синтезу новых гормонов; 2) с появлением новых органов и функций произошла адаптивная молекулярная эволюция имевшегося гормона; 3) обеспечение новых функций произошло путем адаптации тканевых структур к предшествующему гормону. По мнению Barrington и Вагг, с которым мы согласны, синтез эстрогенов был генетически детерминирован задолго до возникновения эстроген-чувствительных органов-мишеней. Действительно, в обзорной работе [145] приводится обширный материал о наличии синтеза Э2 у растений, беспозвоночных, а также у позвоночных, стоящих на самых разных ступенях эволюционной лестницы. В то же время первый орган-мишень репродуктивной системы — яйцевод — появляется лишь у некоторых рыб, а матка — только на самых поздних стадиях эволюции у млекопитающих. Таким образом, отдельные органы-мишени репродуктивной системы имеют различный эволюционный возраст. Тем самым наши данные о неидентичности эстрадиол-рецепторных систем разных органов-мишеней находят объяснение в закономерностях эволюционного процесса.
Имеются основания предположить, что в ходе эволюции по мере усложнения структурной организации и специализации функций диффузная чувствительность к эстрогенам оказалась сконцентрированной в определенных морфологических структурах [146, 165].
Способы гормональной регуляции деятельности органов-мишеней также эволюционно обусловлены. Наиболее общим и, вероятно, наиболее древним способом влияния на гормонозависимые ткани является количественное изменение продукции гормонов соответствующей железой. Классическим примером может служить система гипофиз—надпочечники—гормоночувствительные ткани. Аналогичный подход широко применяется в клинике при ЗГТ после удаления гормонпродуцирующих органов. Подобный способ регуляции, очевидно, неадекватен для тканей, претерпевающих под действием гормона длительные постепенные изменения.
В последние годы было обнаружено существование более совершенного механизма регуляции гормонального эффекта на уровне органов-мишеней. Было показано, что гормоны-антагонисты (например, Э2 и прогестерон) оказывают соответствующий биологический эффект путем блокады синтеза реципрокных рецепторных систем. Так, прогестерон и, вероятно, андрогены блокируют синтез ЭР в матке, снижая тем самым чувствительность этого органа к Э2
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
[165]. Интересно, что эмпирически этот способ регуляции нашел применение в клинике задолго до выяснения его механизма.
Результаты исследований [47,125] позволяют постулировать наличие еще одного физиологического способа регуляции чувствительности органов-мишеней к соответствующим гормонам, а именно временного блокирования рецепторных систем малоактивными метаболитами природных гормонов. Образование метаболитов с низким, но заметным сродством к соответствующим рецепторным системам является хорошо установленным фактом. Поскольку взаимодействие таких метаболитов (как и активных гормонов) с рецепторами подчиняется закону действующих масс, возможна ситуация, когда количественное превалирование неактивных соединений снижает доступность рецепторов для активных гормонов. Конкурентный характер блокирования рецепторов обусловливает обратимость эффекта.
Факт образования больших количеств малоактивных стероидов отмечался отдельными исследователями неоднократно, но не получил убедительного объяснения. Примером может служить интенсивный синтез фетоплацентарной системой эстриола (Э3) — соединения, практически лишенного гормональной активности; концентрация Э3 в крови беременных женщин на порядок превышает концентрацию Э2. К тому же вследствие связывания Э2 с тестостерон-эстрадиол-связывающим глобулином (с этим белком Э3 практически не связывается) отношение концентраций свободных стероидов в крови сдвинуто в пользу Э3 в еще большей степени. Учитывая значения констант ассоциации Э3 и Э2 с рецепторной системой, логично предположить, что в указанных условиях конкуренция этих стероидов за связывающие места может быть фактором, ограничивающим эффект Э2, несмотря на меньшую прочность эстриол-рецепторного комплекса [89]. В нашей лаборатории было показано, что введение морским свинкам Э3 в количестве 250 мкг/животное приводило к 3-кратному снижению связывания Э2 рецепторной системой маток [47].
Таким образом, вопрос о биологической роли Э3, неоднократно ставившийся в литературе, может быть по-новому освещен с позиций участия этого соединения в регуляции эффекта Э2. Известно, что при метаболизме других групп стероидных гормонов также образуются большие количества соединений с выраженным сродством к соответствующим рецепторным системам, но не обладающих соб-
1.5. Состояние репродуктивной системы в период ее активного функционирования
ственной биологической активностью. Представляется, что регуляция чувствительности органов-мишеней посредством обратимого блокирования рецепторов метаболитами гормонов имеет общее физиологическое значение и заслуживает дальнейшего изучения. Указанный способ регуляции может оказаться перспективным и в плане практического использования. Действительно, возможность локальной коррекции состояния органов-мишеней при помощи препаратов, не оказывающих общего биологического эффекта, является заманчивой.
К числу неотъемлемых компонентов репродуктивной системы, состояние которого обеспечивает поддержание репродуктивного гомеостаза в организме женщины, необходимо отнести также и перитонеальную жидкость, являющуюся биологической средой, в которую попадает яйцеклетка после овуляции. Физиологические ее свойства и роль в норме и при различных патологических состояниях репродуктивной системы, особенно сопровождающихся бесплодием, служит предметом пристального изучения в настоящее время. Установлено, что у женщин репродуктивного возраста объем перитонеальной жидкости непостоянен, представлен отделяемым маточных труб, секреторными выделениями яичников и брюшины и контролируется преимущественно эстрогенными влияниями. Содержание эстрогенов в перитонеальной жидкости постепенно возрастает в периовуляторном периоде с незначительным подъемом после овуляции, тогда как концентрация прогестерона резко возрастает непосредственно после овуляции. Контролируемый гормональными влияниями клеточный состав перитонеальной жидкости, куда входят (наряду с прочими элементами) находящиеся на разных стадиях созревания моноцитарные клетки, играет важную роль в поддержании местного иммунного гомеостаза, необходимого при реализации оптимальных условий для жизнедеятельности ооцита и процесса оплодотворения. В этом смысле обеспечение адекватной биологической среды в соответствующем отделе репродуктивной системы за счет перитонеальной жидкости может считаться одной из барьерных функций этой системы.
Параллельно процессу становления сложной и многообразной функции репродуктивной системы в организме женщины формируются и защитные механизмы, обеспечивающие устойчивость ее к различным возможным повреждающим воздействиям, в том числе
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
со стороны инфекционных агентов, которые могут экзо- или эндогенным путем вызывать нарушения этой функции. Биологическая роль этих физиологических барьеров особенно значима у женщин детородного возраста и снижается по мере угасания гормональной активности яичников.
К числу упомянутых защитных механизмов следует прежде всего отнести анатомо-физиологические особенности строения женских половых органов с четким разграничением верхнего и нижнего отделов, что может в значительной мере служить препятствием для интраканаликулярного распространения инфекции. Так, в частности, разобщение влагалища и внешней среды достигается за счет своеобразного строения мышц промежности и тазового дна, которое способствует созданию так называемого «Бульварного кольца» и смыканию половой щели. Большие половые губы с волосяным покровом и малые половые губы прикрывают вход во влагалище и служат дополнительным препятствием для проникновения патогенной флоры в расположенные выше отделы половой системы; этот эффект усиливает также влияние специфического отделяемого больших желез преддверия влагалища.
Не меньшее значение имеет и биологический барьер — способность влагалища к самоочищению в результате циклических превращений гормонозависимого многослойного плоского влагалищного эпителия. Эстрогены (в зависимости от уровня) регулируют процесс созревания последнего и способность к отложению в его орогове-вающих клетках гликогена, а цитолиз непрерывно слущивающихся эпителиальных клеток с последующим ферментативным превращением гликогена в сахар — субстрат гликолиза — обеспечивает образование свободной молочной кислоты, концентрация которой в содержимом влагалища соответствует примерно 0,5% раствору. В результате распад гликогена до молочной кислоты (и воды) оказывается одним из механизмов, поддерживающих кислую реакцию влагалищного содержимого и, следовательно, бактерицидные свойства. При рН 3,8—4,3 отсутствует рост патогенных микроорганизмов и обезвреживаются токсины. Как отмечалось, данный механизм биологической защиты присущ главным образом репродуктивному возрасту и снижение его отмечается в конце беременности, после родов и абортов и в процессе старения.
Верхний отдел половой системы ограничен еще одной преградой — шейкой матки с содержащейся в ее канале слизистой
1.5. Состояние репродуктивной системы в период ее активного функционирования
пробкой и выраженным сужением просвета в области внутреннего зева и перешейка (рис. 1.31). Таким образом, в обычных условиях в половых органах женщины имеется как бы многоступенчатый барьер, отграничивающий их верхний отдел (матку, трубы, яичники) от нижнего. Эта граница проходит в области внутреннего зева и перешейка. Описанные механизмы обеспечивают в физиологических условиях постоянство внутренней среды и устойчивость к восходящей инфекции; последнее особенно важно потому, что интра-каналикулярный путь занимает основное место среди других путей проникновения болезнетворных инфекционных агентов в женскую половую систему.
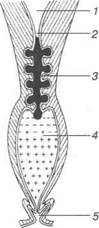
|
Рис. 1.31. Механические и биологические защитные механизмы женских половых органов: 1 — полость тела матки; 2 — перешеек матки (верхний затвор); 3— слизистая пробка шейки матки, преимущественно со щелочной реакцией (средний затвор); 4 — содержимое влагалища — биологический защитный аппарат («-» — щелочная реакция, «+» — кислая реакция); 5 — вульва (нижний затвор)
Высокая чувствительность к гормональным влияниям, обусловленная изменением содержания внутриклеточных рецепторов, вызывает циклические изменения морфологической структуры эндометрия, толщина которого к концу второй фазы цикла возрастает по сравнению с первой в 10 раз. По данным ультразвукового сканирования, толщина предменструального эндометрия достигает 1 см. Как уже указывалось в разд. 1.3, наряду с ростом эндометрия в нем происходят циклические изменения желез, стромы и сосудов. В дополнение к приведенным данным в табл. 1.5 дана схема этих циклических изменений, которую можно использовать для уточнения фазы цикла при морфологических исследованиях соскобов эндометрия.
Глава 1. Структура и функция репродуктивной системы в возрастном аспекте
Таблица 1.5
Дата добавления: 2016-07-09; просмотров: 862;
