Уравнение Клапейрона—Менделеева
Модель идеального газа. Основное уравнение
Молекулярно-кинетической теории газов.
Уравнение Клапейрона—Менделеева
Молекулярно-кинетическая теория, исходя из анализа движения и взаимодействия отдельных молекул, объясняет свойства газообразного состояния вещества и происходящие в газах явления, устанавливает связь между непосредственно определенными на опыте макроскопическими параметрами (давление, температура и т. д.) газа и величинами, характеризуемыми свойствами отдельных молекул.
Эта связь имеет наиболее простой вид для идеального газа, молекулы которого принимаются за материальные точки, не взаимодействующие друг с другом на расстоянии (следовательно, потенциальная энергия молекул такого газа равна нулю). Все возможные взаимодействия молекул идеальногo газа сводятся к их столкновениям. При этом считается, что столкновения молекул друг с другом и с другими телами происходят абсолютно упруго.
Остановимся на выводе основного уравнения молекулярно-кинетической теории газа.
Для этого определим давление газа, оказываемое им на стенки сосуда, в котором он находится. Давление определяется силами, возникающими при столкновении молекул со стенками.
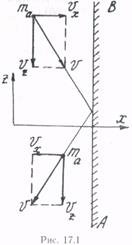
Пусть некоторая молекула газа массой mа, имеющая скорость  упруго соударяется со стенкой АВ сосуда (рис. 17.1).
упруго соударяется со стенкой АВ сосуда (рис. 17.1).
Разложим скорость  на три составляющие по осям х, у и z:
на три составляющие по осям х, у и z:
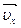 ,
, 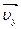 и
и 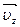 ; причем ось х направим перпендикулярно стенке, оси у и z параллельно стенке. Как видно из рисунка, в peзультате упругого удара перпендикулярная стенке составляющая скорости
; причем ось х направим перпендикулярно стенке, оси у и z параллельно стенке. Как видно из рисунка, в peзультате упругого удара перпендикулярная стенке составляющая скорости 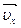 изменила направление на противоположное, две другие составляющие
изменила направление на противоположное, две другие составляющие 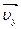 и
и 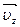 не изменились (
не изменились ( 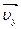 nepпендикулярна плоскости рисунка и поэтому не обозначена). До удара (в перпендикулярном направлении к стенке) молекула имела импульс величиной maυx, после удара -maυx. Таким образом, изменение импульса молекулы равно
nepпендикулярна плоскости рисунка и поэтому не обозначена). До удара (в перпендикулярном направлении к стенке) молекула имела импульс величиной maυx, после удара -maυx. Таким образом, изменение импульса молекулы равно
maυx— (—maυx) = 2 maυx.
Согласно закону сохраненш импульса, такой же импульс, но противоположно направленный получит стенка. Это изменение импульса стенки равно импульсу силы f, действующей со стороны молекулы на стенку за время удара τ:
fτ = 2 maυx. (16.1)
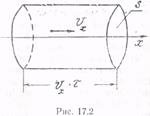
Пусть о площадку S, перпендикулярную оси х, за время τ ударяется N молекул, имеющих одинаковые составляющие υx вдоль оси х. В результате соударения молекул с площадкой S общее изменение импульса стенки согласно (16.1) равно
Fτ=2 maυxN, (16.2)
где F=Nf — сила, действующая на стенку со стороны всех молекул. Число молекул N найдем из следующих соображений. За время τ до площадки S дойдут лишь те молекулы, которые лежат от нее не далее, чем на расстоянии υxτ (рис. 17.2), т. е. те молекулы, которые заключены в объеме цилиндра площадью S и образующей υxτ. Если в единице объема содержится п' молекул, имеющих одинаковые составляющие υx, то в объеме цилиндра их будет υxτSn′. Молекулы движутся хаотично, поэтому все направления движения равноправны. Следовательно, вдоль оси х половина молекул, заключенных в цилиндре, движется к стенке S, другая половина — от нее. Вследствие этого за время τ о площадку S ударяется
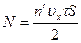 (16.3)
(16.3)
молекул. Из формул (16.2) и (16.3) получаем среднюю силу F, действующую со стороны всех молекул на площадку S:
F =n'ma υx2S.
Откуда величина давления
 (16.4)
(16.4)
Пусть теперь имеем в единице объема п молекул с различными скоростями: п1 молекул имеют скорость υ1, n2 - скорость υ2 и т. д., так что
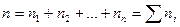 .
.
Обозначим перпендикулярные площадке S составляющие скоростей молекул через υx1, υx2, …,υxn. Давление на площадку S будет равно сумме давлений, оказываемых со стороны всех групп молекул. Согласно формуле (16.4) имеем:
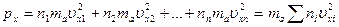 . (16.5)
. (16.5)
Точно такие же формулы мы получим для площадок S, перпендикулярных осям у и z:
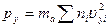 и
и 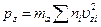 .(16.6)
.(16.6)
Ввиду полной хаотичности движений молекул давление газа в любом направлении должно быть одинаковым, поэтому
рх = ру = рг = р.
Сложив уравнения (16.5) и (16.6), получим
 . (16.7)
. (16.7)
Поскольку сумма квадратов составляющих скорости равна квадрату скорости
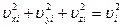 ,
,
то формулу (16.7) можно записать в виде
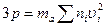 . (16.8)
. (16.8)
Величина
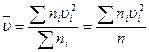 (16.9)
(16.9)
является средней квадратичной скоростью молекул газа. Используя (16.9), выражение (16.8) запишем в виде
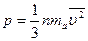
или иначе:
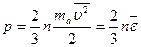 ,
,
где 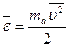 - средняя кинетическая энергия молекулы.
- средняя кинетическая энергия молекулы.
Формула
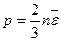 (16.10)
(16.10)
называется основным уравнением молекулярно-кинетической теории. Это уравнение устанавливает связь между средним значением микроскопической величины, характеризующей состояние молекулы — кинетической энергией  поступательно движения молекулы, и термодинамическим параметром, определяющим макроскопическое состояние системы — давлением р.
поступательно движения молекулы, и термодинамическим параметром, определяющим макроскопическое состояние системы — давлением р.
Экспериментально измерить непосредственно  чрезвычайно трудно, поэтому формулу (16.10) целесообразно преобразовать так, чтобы в нее входили только термодинамичесие параметры.
чрезвычайно трудно, поэтому формулу (16.10) целесообразно преобразовать так, чтобы в нее входили только термодинамичесие параметры.
Использовав формулы (15.7) и (16.10), приходим к уравнению
p = nkT. (16.11)
Выразим концентрацию п газа, находящегося в объеме V,черезмассу газа m, молярную массу М и число Авогадро NA:
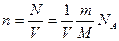 .
.
Подставим это выражение п в (16.11):
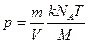 . (16.12)
. (16.12)
Произведение kNA есть универсальная газовая постоянная R = kNA. Таким образом, (16.12) можно записать
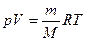 . (16.13)
. (16.13)
Выражение (17.13) представляет собой уравнение Клапейрона—Менделеева, или иначе уравнение состояния идеального газа. Это уравнение оказывается справедливым и для реальных газов в довольно большом диапазоне давлений. Поэтому оно часто используется в инженерной практике.
Дата добавления: 2016-05-25; просмотров: 721;
