Уравнение состояния реального газа
При выводе уравнения Клапейрона—Менделеева (16.13) мы пренебрегали размерами молекул и их взаимодействием друг с другом. Вместе с тем, при повышении давления возрастает плотность газа, что приводит к изменению среднего расстояния между молекулами, в результате чего собственый объем молекул и их взаимодействие друг с другом начинают играть существенную роль. Поэтому для реальных газов с повышением давления и уменьшением температуры наблюдаются все большие и большие отклонения от уравнения Клапейрона—Менделеева.
Из большого числа уравнений, предложенных для описания поведения реального газа, самым простым и в то же время дающим хорошие результаты оказалось уравнение Ван-дер-Ваальса. Оно было получено путем внесения поправок b и pi на объем, занимаемый молекулами и их взаимодействие, в уравнение Клапейрона (уравнение (16.13), написанное для одного моля):
(p+pi)(V0 ─ b) = RT. (17.14)
Оценим величины поправок b и pi. Часть объема, недоступная для движения молекул вследствие их размеров, определяет поправка b. Ее можно связать с эффективным радиусом молекул r. Пусть в сосуде имеются лишь две молекулы (рис. 17.3). Центры молекул O1 и О2 могут приблизиться друг к другу на расстояние, равное эффективному диаметру молекулы d. Следовательно, для обеих молекул оказывается недоступным сферический объем радиуса d:
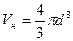
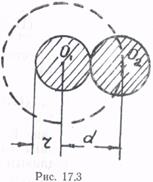
или, так как d = 2r,
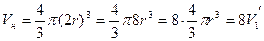 ,
,
где 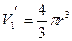 — объем одной молекулы.
— объем одной молекулы.
Соответственно для одной молекулы оказывается недоступным объем
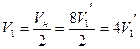 .
.
Если в сосуде находится 1 моль газа, то для всех NA его молекул недоступным оказывается объем
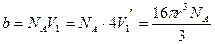 .
.
Отметим, что при выводе поправки b пренебрегли тем, что молекулы не могут подойти к стенке ближе, чем па эффективный радиус молекулы r. Следовательно,для молекул недоступен слой толщиною r, прилегающий к стенке. Если площадь поверхности сосуда S, то объем недоступного слоя равен S∙r. Очевидно, такое пренебрежение при выводе можно делать, если объем S∙r много меньше объема сосуда с газом.
Теперь оценим вторую поправку pi, входящую в уравнение Ван-дер-Ваальса (16.14), обусловленную взаимодействием молекул. При больших расстояниях между молекулами молекулярные силы являются силами притяжения и называются силами Ван-дер-Ваальса. Своим происхождением силы Ван-дер-Ваальса обязаны наличием вокруг молекул собственного электромагнитного поля, собственного или наведенного внешним полем электрического момента. На близких расстояниях, когда электронные оболочки взаимодействующих молекул взаимно проникают друг в друга, возникают силы отталкивания, превосходящие силы притяжения.
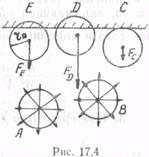 Для определения поправки рi нужно рассмотреть влияние на взаимодействие молекул, находящихся вблизи стенок сосуда, сил Ван-дер-Ваальса. Пусть действие Ван-дер-Ваальсовых сил распространяется на расстояние rв. Окружим каждую молекулу сферой молекулярного действия (т. е. проведем около нее сферу радиусом rв). Если эта сфера находится внутри газа, то результирующая сила, действующая на данную молекулу, равна нулю, поскольку действие ближайших соседей взаимно компенсируется (рис. 17.4, молекулы А и В). Иначе обстоит дело для молекул, находящихся вблизи стенок сосуда — для них сфера молекулярного действия лишь частично проходит в газе (рис. 17.4, молекулы E, D, С). Поэтому для молекул, находящихся вблизи стенки, возникают силы FE, FD, FC, направленные внутрь газа, причем тем больше, чем ближе расположена молекула к стенке. Таким образом, в отличие от идеального газа импульс молекул,
Для определения поправки рi нужно рассмотреть влияние на взаимодействие молекул, находящихся вблизи стенок сосуда, сил Ван-дер-Ваальса. Пусть действие Ван-дер-Ваальсовых сил распространяется на расстояние rв. Окружим каждую молекулу сферой молекулярного действия (т. е. проведем около нее сферу радиусом rв). Если эта сфера находится внутри газа, то результирующая сила, действующая на данную молекулу, равна нулю, поскольку действие ближайших соседей взаимно компенсируется (рис. 17.4, молекулы А и В). Иначе обстоит дело для молекул, находящихся вблизи стенок сосуда — для них сфера молекулярного действия лишь частично проходит в газе (рис. 17.4, молекулы E, D, С). Поэтому для молекул, находящихся вблизи стенки, возникают силы FE, FD, FC, направленные внутрь газа, причем тем больше, чем ближе расположена молекула к стенке. Таким образом, в отличие от идеального газа импульс молекул,
налетающих на стенку, изменяется не только под действием сил давления со стороны стенки, но и под действием Ван-дер-Ваальсовых сил (рис. 17.4, FE, FD, FC), «тянущих» молекулы внутрь газа. В результате газ находится под большим давлением р', чем то давление, которое на него оказывают стенки сосуда: р' = р + рi. Величина рi называется внутренним давлением газа.
Очевидно, сила, «оттягивающая» молекулу из слоя вблизи стенки, пропорциональна концентрации молекул газа. С другой стороны, число молекул, находящихся в слое вблизи стенки, также пропорционально концентрации п. Следовательно, сила, действующая на все молекулы прилегающего к стенке слоя и направленная внутрь сосуда, должна быть пропорциональна n2. Эта сила, отнесенная к единице площади, и определяет внутреннее давление рi:
рi ~ n2.
Итак,
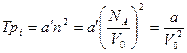 ,
,
где V0 — объем одного моля; а' и 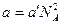 — коэффициенты, зависящие от рода газа. Таким образом, с учетом обеих поправок pi и b уравнение (16.14) можно записать:
— коэффициенты, зависящие от рода газа. Таким образом, с учетом обеих поправок pi и b уравнение (16.14) можно записать:
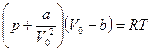 . (16.15)
. (16.15)
Это уравнение Ван-дер-Ваальса для одного моля, справедливое для условий b<<V0 и 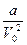 <<p, и, как показывает опыт, для не очень высоких давлений.
<<p, и, как показывает опыт, для не очень высоких давлений.
Уравнение (16.15) можно записать и для любой массы газа m, занимающей объем V, используя связь между объемом газа и молярным объемом V0 ( 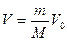 ):
):
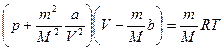 . (16.16)
. (16.16)
Дата добавления: 2016-05-25; просмотров: 554;
