Изотермы Ван-дер-Ваальса. Экспериментальные изотермы
Уравнение Ван-дер-Ваальса (запишем его для одного моля)
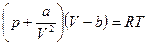 (16.17)
(16.17)
есть алгебраическое уравнение третьей степени относительно V0. Поэтому оно дает либо одно, либо три вещественных решения в зависимости от значений р и Т. (Отметим, что решения не могут быть комплексными, так как объем V0 представляет собой вещественную величину.) Следовательно, при данной температуре одному и тому же давлению может соответствовать либо один, либо три различных объема.
На рис. 17.5 изображены несколько изотерм для различных температур. Как видно, при температуре Т1 давлению соответствуют три объема V1, V1′ и V1′′, при температуре Т2 давлению также соответствует три различных объема V2, V2′ и V2′′.
При высоких температурах (на графике Т3) уравнение Ван-дер-Ваальса имеет лишь один корень. Наименьшая температура Тк, при которой все три корня уравнения становятся равными друг другу, называется критической (соответственно точка перегиба К критической изотермы называется критической). Определим ее параметры.
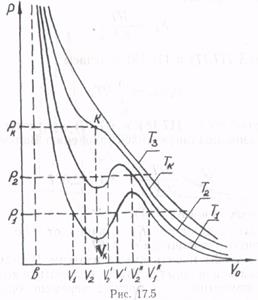
Изобара рк = const для критической точки К (точки перегиба изотермы) является касательной к изотерме, поэтому в критической точке первая и вторая производные равны нулю:
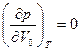 ;
; 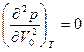 .
.
Решение этих двух уравнений совместно с уравнением Ван-дер-Ваальса дает возможность найти критические значения давления рк, объема V0к и температуры Тк:
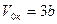 ;
; 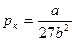 ;
; 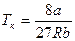 .
.
Таким образом, зная константы а и b, можно определить критические объем, давление и температуру и, наоборот, зная V0к, рк, Тк, определить поправки а и b.
Отступления от формулы Ван-дер-Ваальса, обнаруживаемые реальными веществами, особенно заметны вблизи критической точки.
Критерием, определяющим отступления, может служить критический коэффициент
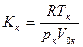 .
.
Из формул (16.17) и (16.18) получаем
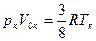 . (16.19)
. (16.19)
Соответственно из (16.18) и (16.19) Критический коэффициент для газов, подчиняющихся уравнению Ван-дер-Ваальса, равен
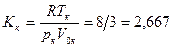
(для идеальных газов Кк = 1).
Эксперименты дают для Кк величины от 3 до 5, т. е. величины, заметно отличающиеся от 2,667.
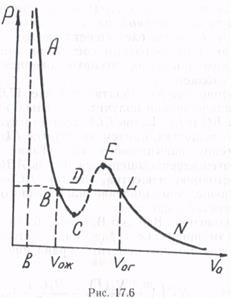
Для того чтобы понять смысл изотерм Ван-дер-Ваальса, нужно обратиться к опыту. Чтобы получить изотерму опытным путем, поместим газ в сосуд с перемещающимся поршнем и начнем последовательно сжимать газ, поддерживая постоянной температуру. Вначале с уменьшением объема (рис. 17.6, участок NL)давление газа растет, причем ход опытной изотермы хорошо совпадает с ходом изотермы Ван-дер-Ваальса. Однако, начиная с некоторого объема V0r (точка L), опытная изотерма перестает следовать теоретической: давление перестает меняться (на участке BDL р = const), поскольку часть газа конденсируется в жидкость. Когда все вещество перейдет в жидкую фазу (рис. 17.6, точка В, объем V0ж), последующее уменьшение объема сопровождается быстрым ростом давления, поскольку жидкость почти не сжимается. На участке АВ ход экспериментальной и теоретических изотерм совпадает. Таким образом, уравнение Ван-дер-Ваальса описывает не только газообразное состояние вещества, но и охватывает переход вещества из газообразной фазы в жидкую и процесс сжатия жидкости.
На рис. 17.7 приведены семейства изотерм уравнения Ван-дер-Ваальса (а) и экспериментальных (б). Как видно, «горбатые» участки изотерм Ван-дер-Ваальса соответствуют существованию одновременно двух фаз вещества: жидкости и
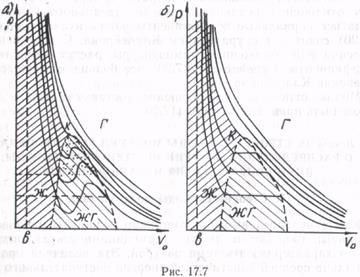
пара (область ж—г). На экспериментальных изотермах эти участки выглядят как изобары (прямые линии). Области существования только жидкой фазы (область ж) на рис. 17.7 заштрихованы; область, где вещество может находиться как в жидком, так и газообразном состоянии, заштрихована линиями с другим наклоном, незаштрихованная область относится к газу (область г).
В заключение еще раз обратимся к рис. 17.6. Оказывается, экспериментально можно получить не только кривую ABDLN, но и участки ВС и EL. Ветвь ELN соответствует газообразному состоянию вещества, причем на участке EL давление пара больше давления насыщенного пара. Такие пары (участок EL)называются перенасыщенными. Ветвь АВС соответствует жидкому состоянию вещества, участок ВС—жидкости, где давление меньше, чем давление насыщенного пара; это состояние перегретой жидкости.
Кроме уравнения Ван-дер-Ваальса, были предложены и другие полуэмпирические уравнения состояния реального газа. Среди них можно отметить уравнение Камерлинга -Оннеса:
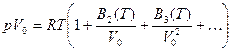 (16.20)
(16.20)
Параметры В2(Т), В3(Т) ... получили название второго, третьего и т. д. вириальных коэффициентов. Эти коэффициенты, являющиеся функциями температуры, характеризуют степень отклонения реального газа от идеального. Очевидно, когда все вириальные коэффициенты равны нулю, уравнение (16.20) совпадает с уравнением Клапейрона. С повышением давления или понижением температуры растут вириальные коэффициенты и уравнение (16.20) все больше отличается от уравнения Клапейрона.
Можно отметить, что уравнение состояния любого газа может быть приведено к виду (16.20).
Дата добавления: 2016-05-25; просмотров: 2864;
