Б. Лекарственные средства
Лекарственные средства (субстанции), используемые для изготовления инъекционных растворов, должны отвечать требованиям ГФ, ФС, ВФС. Некоторые вещества подвергают дополнительной очистке и выпускают повышенной чистоты, квалификации «годен для инъекций» (глюкоза, желатин, пенициллин и др.).
В частности, в глюкозе и желатине (благоприятные среды для размножения микроорганизмов) могут содержаться пирогенные вещества. Поэтому для них определяют тест-дозу на пирогенность в соответствии со статьей ГФ «Проверка пирогенности». Глюкоза не должна давать пирогенный эффект при внутривенном введении 5% раствора из расчета 10 мг/кг массы кролика, желатин - 10% раствора. Бензилпенициллина калиевую соль также проверяют на пирогенность (тест-доза не должна превышать 5000 ЕД в 1 мл воды на 1 кг массы кролика) и испытывают на токсичность.
Пригодность некоторых лекарственных веществ для инъекционных растворов определяют на основании дополнительных иссле- дований на чистоту. Кальция хлорид проверяют на растворимость в этаноле (органические примеси) и содержание железа; гексаметилентетраамин - на отсутствие аминов, солей аммония и хлороформа; кофеин-бензоата натрия - на отсутствие органических примесей (раствор не должен мутнеть или выделять осадок при нагревании в течение 30 мин). Магния сульфат для инъекций не должен содержать марганца и других веществ, что отмечено в нормативной документации.
Натрия гидрокарбонат квалификации х.ч., ч.д.а., «годен для инъекций», отвечающий требованиям ГОСТа 4201, должен выдерживать дополнительное требование на прозрачность и бесцветность 5% рас- твора. Ионов кальция и магния должно быть не более 0,05%, иначе в процессе термической стерилизации раствора будет появляться опалесценция карбонатов этих катионов.
Эуфиллин для инъекций должен содержать повышенное количество этилендиамина (18-22%) как стабилизатор этого вещества вместо 14-18% при использовании его для пероральных растворов и выдерживать дополнительное испытание на растворимость.
Натрия хлорид (х.ч.), выпускаемый по ГОСТу 4233, должен соответствовать требованиям ГФ, калия хлорид (х.ч.) должен отвечать требованиям ГОСТа 4234 и ГФ. Натрия ацетат квалификации ч.д.а. должен отвечать требованиям ГОСТа 199.
Натрия бензоат не должен содержать более 0,0075% железа.
Тиамина бромид для инъекций должен выдерживать дополнительное испытание на прозрачность и бесцветность раствора.
Лекарственные вещества, используемые для приготовления инъекционных растворов, хранят в отдельном шкафу, в стерильных небольших штангласах, закрытых притертыми пробками. Штангласы
перед каждым заполнением лекарственными веществами моют и стерилизуют в соответствии с приказом Минздрава. В. Вспомогательные вещества
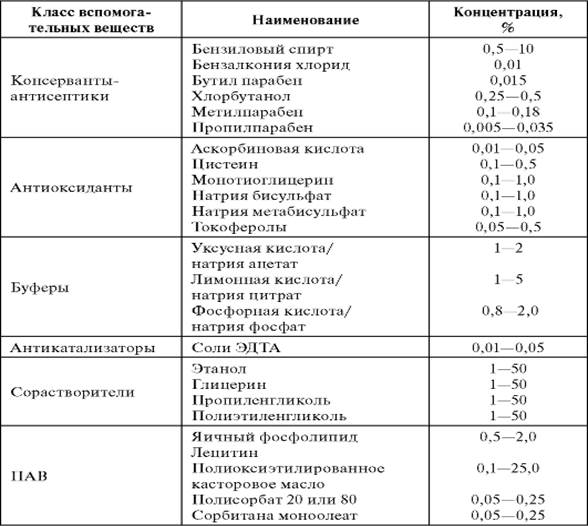
При изготовлении лекарственных средств для парентерального применения могут быть добавлены консерванты, антиоксиданты, стабилизаторы, эмульгаторы, солюбилизаторы и другие вспомогательные вещества, указанные в частных статьях.
В качестве вспомогательных веществ - ингибиторов физикохимических процессов, препятствующих гидролизу и окислению лекарственных средств, используют: аскорбиновую, хлористо-водородную, винную, лимонную, уксусную кислоты, натрия карбонат, натрия бикарбонат, натр едкий, натрия или калия сульфит, бисульфит или метабисульфит, натрия тиосульфат, натрия цитрат, натрия фосфат одно- и двузамещенный, натрия хлорид, метиловый эфир оксибензойной кислоты, пропиловый эфир оксибензойной кислоты, ронгалит, динатриевую соль этилендиаминтетрауксусной кислоты, спирт поливиниловый, хлоробутанол, крезол, фенол и др.
Количество добавляемых вспомогательных веществ, если нет других указаний в частных статьях, не должно превышать следующих концентраций: для веществ, подобных хлорбутанолу, крезолу, фенолу, - до 0,5%; для сернистого ангидрида или эквивалентных количеств сульфита, бисульфита или метабисульфита калия или натрия - до 0,2%.
Консерванты (табл. 5.3) применяют в многодозовых лекарственных средствах для парентерального применения, а также в однодозовых препаратах в соответствии с требованиями частных статей.
Лекарственные средства для внутриполостных, внутрисердечных, внутриглазных или других инъекций, имеющих доступ к спинномозговой жидкости, а также при разовой дозе, превышающей 15 мл, не должны содержать консервантов.
Правило 1
Приказ № 214 требует указания концентрации и объема (или массы) изотонирующих и стабилизирующих веществ, добавленных в растворы для инъекций и инфузий, не только в паспортах, но и на рецептах.
Г. Тара и упаковка
Растворы для инъекций упаковывают во флаконы, укупоривают пробками и закатывают колпачками.
Таблица 5.3.Вспомогательные вещества и их концентрация в растворах для инъекций
Сосуды и укупорочные средства должны обеспечивать герметичность, быть индифферентными к содержимому, сохранять его стабильность при стерилизации, хранении и транспортировании. Марки стекла и других укупорочных средств (резины, пластмассы) должны быть указаны в частных статьях. Сосуды изготавливают из материалов, не затрудняющих визуальный контроль содержимого.
Рис. 5.9.Бутылка для крови, трансфузионных и инфузионных препаратов, ГОСТ 10782
Бутылки для инфузионных растворов и кровезаменителей с гладким горлом (рис. 5.9) изготавливаются из медицинского стекла марки МТО. Они предназначены для расфасовки и хранения крови, кровезаменителей, инфузионных и трансфузионных растворов. Емкость - 100, 250 и 450 мл. Внутренняя поверхность бутылок обработана для обеспечения химической стойкости. Бутылки с внутренним химически стойким покрытием нельзя использовать повторно после хранения в них препаратов в течение гарантийного срока годности. Гарантийный срок хранения - 1 год с даты изготовления.
В настоящее время широко применяются бутылки из полиэтилена или полипропилена (рис. 5.10). Преимуществом данной тары явля- ется совместимость с любыми растворами и возможность стерилизации паром в стандартных условиях.
Бутылки укупоривают пробками резиновыми для бутылок с кровью, кровезаменителями и инфузионными растворами (рис. 5.11). Материал пробки должен быть достаточно прочным и эластичным, чтобы обеспечивать отбор содержимого без удаления пробки, отделения ее частиц и герметизацию сосуда после удаления иглы.

Рис. 5.10.Бутылки из полиэтилена высокого давления для инфузионных препаратов

Рис. 5.11.Пробки резиновые 4Ц для укупоривания бутылок с кровью, кровезаменителями и инфузионными растворами

Рис. 5.12.Колпачки алюминиевые
Для фиксации пробки на нее и горло бутылки устанавливают алюминиевый колпачок (рис. 5.12), который завальцовывают. Одновременно с обеспечением плотной укупорки достигается контроль вскрытия инъекционных растворов. Колпачки изготовлены из алюминиевой фольги толщиной 0,2 мм. В процессе производства обязательно осуществляют обезжиривание после штамповки, химическую обработку и 100% выходной контроль
Дата добавления: 2017-02-04; просмотров: 1539;
