Термодинамическая вероятность W состояния тела или системы
— это число способов, которыми может быть реализовано данное конкретное термодинамическое состояние (макросостояние). Иначе говоря, это число всевозможных микрораспределений частиц по координатам и скоростям (микросостояний), которыми может быть осуществлено данное макросостояние.
Формула Больцмана:S = klnW
где k—постоянная Больцмана.
Энтропия системы определяется логарифмом числа микросостояний, спомощью которых может быть реализовано данное макросостояние.
Энтропия является мерой неупорядоченности системы, — чембольше число микросостояний, реализующих данное макросостояние, тем больше энтропия.
44. Принцип возрастания энтропии.
Все процессы в замкнутой системе ведут к увеличению её энтропии. В замкнутой системе идут в направлении от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. В состоянии равновесия — наиболее вероятного состояния системы — число микросостояний максимально, при этом максимальна и энтропия.
45. Второе начало термодинамики.
| Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает(закон возрастания энтропии). |
Первое начало термодинамики выражает закон сохранения и превращения энергии применительно к термодинамическим процессам.
Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие — нет.
Существуют ещё две формулировки второго начала термодинамики, эквивалентных закону возрастания энтропии:
1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к телу более нагретому.
46.Третье начало термодинамики.
| Третье начало термодинамики — теорема Нернста-Планка — постулирует поведение термодинамических систем при нуле Кельвина (абсолютном нуле): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина. | 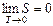
|
Теплоемкости Cv и Сp при Т = 0 К равны нулю, поскольку:

47.Тепловые двигатели и холодильные машины.
Тепловой двигатель — это периодически действующий двигатель, совершающий работу за счет полученной извне теплоты.
Термостатом называется термодинамическая система, которая может обмениваться теплотой с телами практически без изменения собственной температуры.
Рабочее тело — это тело, совершающее круговой процесс и обменивающееся энергией с другими телами.
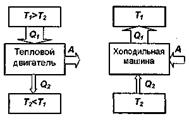
Принцип работы теплового двигателя: от термостата с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количество
|
теплоты Q1, а термостату с более низкой температурой Т2, называемому холодильником, за цикл передается количество теплоты Q2, при этом совершается работа A = Q1 -Q2.
Термический КПД двигателя:
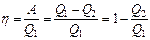
Чтобы КПД был равен 1, необходимо, чтобы Q2=0, а это запрещено вторым началом термодинамики.
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине: от термостата с более низкой температурой Т2 за цикл отнимается количество теплоты Q2 и отдается термостату с более высокой температурой Т1 > Т1. Приэтом Q = Q1 - Q2 = А или Q1= Q2 + A
Количество теплоты Q1, отданное системой термостату Т1, больше количества теплоты Q2, полученного от термостата Т2 на величину работы, совершенной над системой.
Эффективность холодильной машины характеризует холодильный коэффициент η’ — отношение отнятой от термостата с более низкой температурой количества теплоты Q2 к работе А, которая затрачивается на приведение холодильной машины в действие:
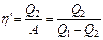
48. Теорема Карно
| Извсех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей Т1 и холодильников Т2, наибольшим КПД обладают обратимые машины. При этом КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от природы рабочего тела, а определяются только температурами нагревателя и холодильника. |
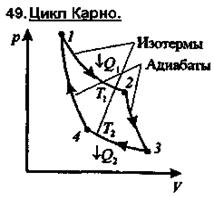
|
Наиболее экономичный обратимый круговой процесс, состоящий из двух изотерм и двух адиабат.
Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
Последовательные термодинамические процессы в цикле Карно
1-изотерма-2-адиабата-3-изотерма-4-адиабата-1:
| Изотермическое расширение 1—2 Т = const; V2 > V1 | 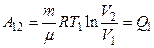
|
| Адиабатическое расширение 2—3 δQ = 0; Т2<Т1 | 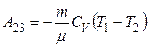
|
| Изотермическое сжатие 3—4 Т = const; V4 < V3 | 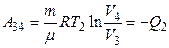
|
| Адиабатическое сжатие δQ = 0; Т1>Т2 | 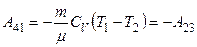
|
Работа, совершаемая в результате кругового процесса,
A = A12 + A23+A34 + A41=Q1 + А23 -Q2+ А23 = Q1-Q2
Для адиабат 2-3 и 4-1 уравнения Пуассона: 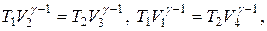 откуда V1/V2=V3/V4.
откуда V1/V2=V3/V4.
Используя это, термический КПД цикла Карно:
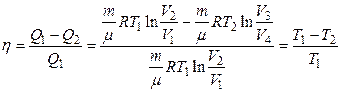
действительно определяется только температурами нагревателя и холодильника.
| Реальные газы, жидкости и твердые тела. |
При рассмотрении реальных газов необходимо учитывать собственный объем молекул и силы межмолекулярного взаимодействия.
Силы межмолекулярного взаимодействия — короткодействующие — они проявляются на расстояниях менее 10-9м. Сила взаимодействия молекул — это равнодействующая сил притяжения Fп (они преобладают на больших расстояниях) и сил отталкивания Fо (они доминируют на малых расстояниях). На расстоянии r = rо эти силы уравновешивают друг друга и F = 0. Таким образом, расстояние го — это равновесное расстояние между молекулами, на котором бы они находились в отсутствие теплового движения. Потенциальная энергия взаимодействия молекул U минимальна всостоянии устойчивого равновесия при r = rо.
 Соотношение между Uтin и kT является критерием различных агрегатных состояний. Umin определяет работу, которую нужно совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии (r = ro). kТ определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы теплового движения молекул.
Соотношение между Uтin и kT является критерием различных агрегатных состояний. Umin определяет работу, которую нужно совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии (r = ro). kТ определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы теплового движения молекул.
При Umin<<kТ вещество находится в газообразном состоянии, т.к. тепловое движение молекул препятствует соединению (конденсации) молекул.
Дата добавления: 2016-04-22; просмотров: 3167;
