Уравнение политропы
pVn = const
где коэффициент 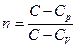 называется показателем политропы.
называется показателем политропы.
Значения теплоемкости и показателя политропы для разных процессов приведены в таблице.
| Процесс | С | n |
| Адиабатический | С = 0 | n = у |
| Изотермический | С =∞ | n = 1 |
| Изобарический | C=Cp | n = 0 |
| Изохорный | C=CV | n =±∞ |
Теплоемкость при изотермическом процессе бесконечно велика, поскольку dT = 0, в то время как δQ≠0.
Теплоемкость при адиабатическом процессе равна нулю, поскольку δQ=0, в то время как dT ≠ 0

|
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. На (р,V)-диаграмме цикл изображается замкнутой кривой, где участок 1-2 соответствует расширению, а 2-1 — сжатию газа.
Работа расширения А1 (площадь фигуры 1a2V2V11) положительна: А1 >0. Работа сжатия А2 (площадь фигуры 2b1V1V22) отрицательна: А2 < 0.
Работа зацикл А определяется площадью, охватываемой замкнутой кривой:
А = А1 + А2
Таким образом, работа — это функция не только состояния термодинамической системы, но и вида процесса, который происходит. Поэтому работа не является однозначной функцией состояния (такой, как внутренняя энергия). Из первого начала термодинамики следует, что теплота Q, так же как и работа А, является функцией процесса, который происходит с системой.
Цикл называется прямым, если за цикл совершается положительная работа A = 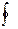 pdV > О (цикл протекает по часовой стрелке — рисунок (А)).
pdV > О (цикл протекает по часовой стрелке — рисунок (А)).
Цикл называется обратным, если за цикл совершается отрицательная
работа А = 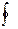 pdV < О (цикл протекает против часовой стрелки — рисунок (Б)).
pdV < О (цикл протекает против часовой стрелки — рисунок (Б)).
Прямой цикл используется в тепловых двигателях (совершают работу за счет полученной извне теплоты). Обратный цикл используется в холодильных машинах (за счет работы внешних сил теплота переносится к телу с более высокой температурой).
39. КПД кругового процесса.
В результате кругового процесса система возвращается в исходное состояние, следовательно, полное изменение внутренней энергии равно нулю. Поэтому Q = ΔU + А = А, т.е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Если в ходе кругового процесса система не только получает количество теплоты Q1, но и теряет (отдает) количество теплоты Q2, то Q= Q1- Q2.
Термический коэффициент полезного действия для кругового процесса — это величина, равная отношению работы, совершенной системой, к количеству теплоты, полученному в этом цикле системой:
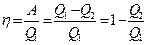
40. Обратимый и необратимый процессы.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Реальные процессы необратимы, в них всегда происходит диссипация (потеря) энергии (из-за трения, теплопроводности и т.д.). Обратимые процессы — это физическая модель — это идеализация реальных процессов.
41 .Энтропия.
Количество тепла δQ, которое должно быть доставлено системе или отнято у неё при переходе от одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода (δQ не является функцией состояния
системы).
Однако, приведенное количество теплоты — отношение теплоты δQ к температуре Т системы при бесконечно малых изменениях состояния системы — есть функция состояния системы. В любом обратимом круговом процессе
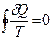
Следовательно, подынтегральное выражение есть полный дифференциал некоторой функции, которая определяется только начальным и конечным состояниями системы и не зависит от пути, каким система пришла в это состояние.
ЭнтропиейS называется функция состояния системы, дифференциалом которой является δQ/T:
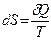
Т.о. первое начало термодинамики δQ = dU + δА можно записать в виде TdS = dU + δA, откуда δА = TdS -dU= d(TS) - SdT -dU = -d(U - TS) - SdT = -dF - SdT
Функция F =U-TS является функцией состояния системы и называется энергией Гельмгольца или свободной энергией.
42. Изменение энтропии.
В замкнутой системе для обратимых процессов ΔS = 0; для необратимых циклов ΔS > 0.
| Неравенство Кпаузиуса: энтропия замкнутой системы может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов). | ΔS≥0 |
Поскольку dS и δQ имеют один и тот же знак, то по характеру изменения энтропии можно судить о направлении процесса теплообмена. При нагревании тела δQ>0 и его энтропия возрастает dS>0, при охлаждении δQ<0 и
энтропия тела убывает dS < 0.
Изоэнтропийнымназывается процесс, протекающий при постоянной энтропии (S = const).
В обратимом адиабатическом процессе δQ = TdS = 0, так что dS = 0 и S — const, поэтому адиабатический процесс является изоэнтропийным.
Рассмотрим для примера идеальный газ, который совершает равновесный переход из состояния 1 в состояние 2. Изменение его энтропии
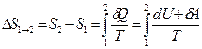
Используя 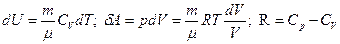 и
и 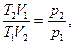
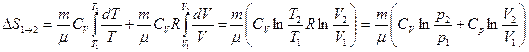
Дата добавления: 2016-04-22; просмотров: 945;
