Уравнение Ван-дер-Ваальсадля моля газа — уравнение состояния
реальных газов: 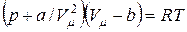 . Для произвольной массы газа:
. Для произвольной массы газа:
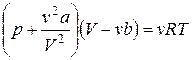 , где
, где 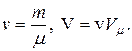
51. Изотермы реальных газов.
Изотерма реального газа представляет собой зависимость молярного объема газа от давления при постоянной температуре.
При высоких температурах (Т>Тk) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы.
 При некоторой температуре Тk— критической температуре— на изотерме появляется точка перегиба К — критическая точка. Соответствующие этой точке объем Vk и давление рк называются критическими.Изотерма при Тk называется критической изотермой.
При некоторой температуре Тk— критической температуре— на изотерме появляется точка перегиба К — критическая точка. Соответствующие этой точке объем Vk и давление рк называются критическими.Изотерма при Тk называется критической изотермой.
При Т < Тk уравнению Ван-дер-Ваальса соответствует кривая 1-2-3-4-5-6-7. Однако, на участке 5-3 сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы — жидкость и пар.
Фаза — совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом термодинамическом состоянии
Истинные докритические изотермы реального газа имеют вид 1-2-6-7 и являются кривыми непрерывного перехода вещества из газообразного состояния (Г) (участок 6-7) в жидкое (Ж) (участок 2-1). Участок 6-2 соответствует равновесному сосуществованию жидкости и газа.
Вещество в газообразном состоянии при температуре ниже критической называется паром (П), а пар, находящийся в равновесии со своей жидкостью, называется насыщенным (Ж + П). Пар при изотермическом сжатии претерпевает процесс сжижения. Газ при температурах Т>Тk не может быть превращен в жидкость ни при каком давлении (Г).
При некоторых условиях могут быть реализованы метастабильные состояния 5-6 и 2-3. Участок 2-3 изображает перегретую жидкость, 5-6 — пересыщенный пар.
52. Внутренняя энергия реального газа.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения молекул (CVT) и потенциальной энергии межмолекулярного взаимодействия 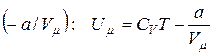
Если газ расширяется без теплообмена с окружающей средой (адиабатически, т.е. δQ = 0) и не совершает работы (так называемое расширение газа в вакуум, т.е. δА = 0), из первого начала термодинамики (δQ = (U2-U1) + δA) следует, что: U1=U2.
Дата добавления: 2016-04-22; просмотров: 582;
