Склад та класифікація природних газів
Природні гази, що видобуваються з чисто газових, нафтових та газоконденсатних родовищ, складаються із вуглеводнів гомологічного ряду метану з загальною формулою СnН 2n+2, а також невуглеводневих компонентів: N2, СО2, Н2S, благородних (інертних) газів: гелію, аргону, криптону, ксенону; ртуті.
Метан (СН4), етан (С2Н6) і етилен (С2Н4) за нормальних умов (р = 0,1 МПа і Т = 273° К) є нормальними газами.
Пропан (С3Н8), пропілен (С3Н6), і-бутан (і-С4Н10), н-бутан (n-С4Н10), бутилени (С4Н8) в атмосферних умовах знаходяться в паровидному (газовидному) стані; при підвищених тисках - в рідкому стані. Вони входять у склад рідких (зріджених, скраплених) вуглеводневих газів.
Вуглеводні, починаючи з і-С5Н12 до С17Н36, в атмосферних умовах перебувають у рідкому стані.
Вуглеводні, в молекулу яких входить 18 і більше атомів вуглецю (від С18Н38), розміщених в одному ланцюжку, в атмосферних умовах перебувають у твердому стані.
Природні гази поділяються на три групи:
1 Гази, які видобуваються з чисто газових родовищ. Це переважно сухий газ, який є вільним від важких вуглеводнів.
2 Гази, які видобуваються разом з нафтою. Це фізична суміш сухого газу, пропан-бутанової фракції (скрапленого газу) та газового бензину.
3 Гази, які видобуваються з газоконденсатних родовищ. Вони складаються з сухого газу та рідкого вуглеводневого конденсату, який містить велику кількість важких вуглеводнів, з яких можна видобувати бензинові, лігроїнові, гасові, а часом і більш важкі олив'яні (масляні) фракції.
Для визначення багатьох властивостей природних газів використовується рівняння стану.
Рівнянням стану називається аналітична залежність між параметрами, які описують зміни простої або складної речовини. Такими параметрами є тиск, об'єм і температура.
Менделєєв і Клапейрон запропонували таке рівняння стану ідеальних газів:
| Р · V = G ∙ R · Т , | (4.24) |
де Р - абсолютний тиск, Па;
V - об'єм, м3;
G - маса речовини, кг;
Т - абсолютна температура, К;
R - питома газова постійна, Дж/ кг·град.
Ідеальним називається газ, власний об'єм молекул якого малий у порівнянні з об'ємом, який займає газ, і між молекулами якого немає взаємодії (взаємодією між молекулами можна нехтувати).
Практично ідеальним можна називати газ, тиск якого зростає вдвічі під час зменшення його об'єму наполовину за умови постійної температури або ідеальним можна назвати газ, тиск якого збільшиться вдвічі із збереженням об'єму, але з підвищенням вдвічі абсолютної температури.
Якщо газ із збільшенням тиску вдвоє займе об'єм, який менший половини початкового, то його називають надстисливим (надпружним)
Число, яке визначає характер та ступінь відхилення поведінки реального газу від поведінки ідеального газу, називається коефіцієнтом надстисливості (надпружності) газу Z.У літературі зустрічається його назва як коефіцієнт девіації газу Zі. Величина Z може змінюватись у межах від 0.7 до 12.
Коефіцієнт девіації газу за своєю суттю - це відношення об'єму, який фактично займає газ за даних тиску і температури, до об'єму, який він займав би в ідеальному стані.
Газ є ідеальним, коли відношення Р ·V / G · R · Т = ½.
Для реальних газів Ван-дер-Ваальс запропонував рівняння стану, яке дозволяло враховувати власний об'єм молекул газу та сили їх взаємного притягання шляхом введення у рівняння Клапейрона додаткових членів:
| ( Р + а/υ2)·( υ - b) = R · Т, | (4.25) |
де υ = V / G - питомий об'єм газу, м3/ кг;
а - константа зчеплення молекул, Па*мб/кг2;
а/υ2 - внутрішній тиск, що є ніби рівнодійною сил притягання всіх молекул в об'ємі V;
b - почетверенний об'єм молекул.
Рівняння Ван-дер-Ваальса все ж виявляється наближеним, так як коефіцієнти а і b-вдійсності складні функції об’єму, температури, форми молекул газу. Це рівняння стану дає задовільні результати для реальних газів лише при тисках до 10 МПа і температурах 283-293 К, але воно не може чисельно описувати поведінку природних вуглеводневих газів гомологічного ряду метану. Щоб поправки можна було деталізувати, їх виражають через критичний тиск та критичну температуру.
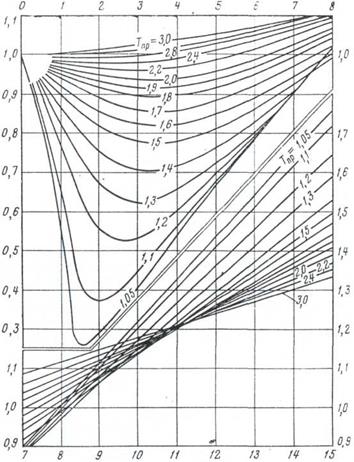
Д.Браун і Д.Катц на основі вивчення результатів своїх експериментальних вимірів коефіцієнта відхилення реальних газів Z від законів ідеального газового стану встановили, що якщо приведені параметри різних природних газів однакові (Рпр, Тпр), то вони знаходяться у відповідних станах, при яких їх фізичні і термодинамічні властивості (Z, густина і ін.) однакові, тобто Z = f (Рпр, Тпр) і побудували графічні залежності для практичного використання (рисунок 4.1).
Критична температура чистої речовини - це максимальна температура, при якій рідка і парова фази ще можуть існувати в рівновазі, або така температура, при якій середня молекулярна кінетична енергія стає рівною потенціальній енергії притягання молекул. За більш високої температури існування рідкої фази неможливе.
Тиск парів речовини при критичній температурі називається критичним тиском, а об’єм речовини за умови Ркр і Ткр, який віднесений до одного моля або до одиниці маси речовини, називається критичним питомим об’ємом.
Приведеними параметрами індивідуальних компонентів називаються безрозмірні величини, які показують, у скільки разів дійсні параметри стану газу (тиск, абсолютна температура,
| Коефіцієнт надстисливості z | Приведений тиск Рпр | Коефіцієнт надстисливості z |
| ||
| Приведений тиск Рпр |
Рисунок 4.1 – Залежність коефіцієнта надстисливості природного газу від приведених тиску і температури Рпр і Тпр.
об'єм, густина, коефіцієнт відхилення або девіації) більші або менші від критичних.
| Рпр = Р/ Ркр; Тпр = Т/Ткр; Vпр =V/ Vпр; ρпр = ρ/ ρкр; zпр = z/ zкр. | (4.26) |
Реальні пластові гази є фізичними сумішами великої кількості вуглеводневих і невуглеводневих компонентів, простих і складних газів, кожний з яких має свої критичні показники тиску і температури.
Знаючи компонентний склад газу, визначають середні (псевдокритичні) величини тиску Рпс.кр і температури Тпс.кр.
| Рпс.кр = Σ хі ·Ркр.і; Тпс.кр = Σ хі· Ткр.і. | (4.27) |
Якщо компонентний склад газової суміші невідомий, а відома відносна густина суміші, то для знаходження псевдокритичиних тисків і температур існують наступні емпіричні залежності:
| Тпс.кр = 190,7 + 94,717 · ρсум´, | (4.28) |
| Рпс.кр = 4,892 + 0,4048 · ρсум´, | (4.29) |
де ρсум´ - відносна густина газової суміші, розрахована за молекулярною масою суміші та молярною долею компонентів в ній.
Розрахувавши за наведеними формулами критичні чи псевдокритичні значення тиску і температури і поділивши, відповідно, дійсні значення цих параметрів на розраховані, за графіками Брауна-Катца знаходять параметр z.
Значення коефіцієнта z можна знайти і за емпіричною формулою, знаючи приведені тиски і температури:
| Z = (0,4lg Тпр + 0,73)Рпр + 0,1Рпр. | (4.30) |
Дата добавления: 2016-04-19; просмотров: 929;
