З карбонових кислот.
2.1. Електролізом солей карбонових кислот (Кольбе, 1849):
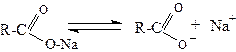
На аноді аніон карбонової кислоти віддає електрон (окиснюється), утворюючи вільний радикал,

який одразу декарбоксилює (відщеплює СО2):
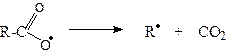
Рекомбінація утворених вільних радикалів дає молекулу алкану:

Алкан
2.2. Піроліз солей карбонових кислот у присутності твердого лугу:
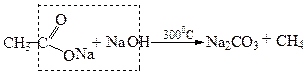
Натрій ацетат
2. Каталітичне гідрування ненасичених вуглеводнів.
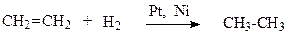
етен етан
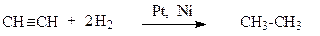
етин
ФІЗИЧНІ ВЛАСТИВОСТІ
Перші чотири представники алканів С1-C4 — гази, С5-С15 — рідини, а починаючи з С16 — тверді речовини. Підвищення їх молекулярної маси приводить до зростання температур кипіння і топлення.
Причому, алкани з розгалуженим ланцюгом киплять при нижчій температурі, ніж алкани нормальної будови. Це пояснюється меншою взаємодією між молекулами розгалужених вуглеводнів у рідкому стані. Крім того, температура плавлення нерозгалужених алканів з парним числом атомі вуглецю є вищою ніж з непарним.
ХІМІЧНІ ВЛАСТИВОСТІ
Атоми вуглецю в алканах перебувають в sp3-гібридному стані та зв`язані між собою тільки σ-зв`язками. Крім σ (C-C)-зв`язків існують σ (C-H)-зв`язки, утворені за рахунок sp3-гібридних орбіталей атома вуглецю та s-орбіталі атома водню. Отже, за своєю природою алкани повністю насичені сполуки і не вступають уреакції приєднання. Що стосується їх реакційної здатності, то вони досить інертні і не взаємодіють за нормальних умов з кислотами, лугами, окиснювачами, активними металами.
Таким чином, насичений характер алканів зумовлює можливість протікання наступних типів реакцій:
1) реакцій заміщення водню (S);
2) реакцій розщеплення молекули (за зв’язками С—С або С—Н) (E);
3) реакцій ізомеризації (I).
В окрему групу можна виділити реакції окиснення.
Оскільки С—С, і С—Н-зв’язки характеризуються незначною полярністю, алкани неохоче вступають в йонні реакції. Найбільш характерними для них є радикальні реакції.
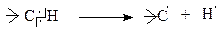
Величина енергії σ-зв‘язку С—С складає 314-368 кДж/моль, а σ-зв’язку С—Н 375-425 кДж/моль. Однак, частіше розриваються стійкіші С—Н-зв‘язки, тому що вони доступніші для атаки реагентів. Реакційна здатність С—Н-зв‘язку зменшується при переході від третинних до первинних атомів вуглецю.
Наприклад, енергія дисоціації зв‘язку С—Н на вільні радикали за схемою:
змінюється таким чином:
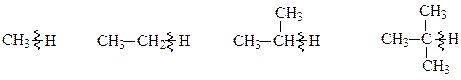
425 406 395 375 кДж/моль
Видно, що вільнорадикальні реакції протікають переважно з розривом С―Н-звязку біля третинного атому вуглецю (цей зв’язок характеризується найменшою енергією), далі – біля вторинного і, в останню чергу, — біля первинного.
Реакції заміщення (S).
Галогенування.
Швидкість взаємодії з галогенами знижується в ряді:
F > Cl > Br > I.
Взаємодія з фтором протікає з вибухом, хлор реагує при температурі 250-400oС або при опромінюванні УФ-світлом, бромування протікає в 250.000 разів повільніше від хлорування, і також потребує нагріву, а з йодом алкани практично не реагують
Фторування

| ΔH=435, кДж/моль |
Реакція фторування сильно екзотермічна, тому її важко контролювати і вона часто закінчується вибухом. У промисловості для уникнення вибуху фтор розбавляють азотом і проводять реакцію в розчиннику — фторованому алкані. Але і в цьому випадку реакція завершується вичерпним фторуванням:
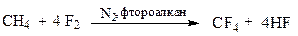
1.2. Хлорування алканів під дією УФ-опромінювання або в темноті при 250-400о протікає за радикало-ланцюговим механізмом (SR).
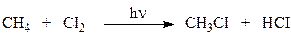
Цей механізм включає три стадії.
Перша стадія — зародження ланцюга (ініціювання):
Під дією УФ-світла молекула хлору переходить у збуджений стан (СІ2٭) і в кінці кінців розпадається на атоми. Атом хлору має на зовнішньому рівні 7 електронів (3 пари і 1 неспарений), отже він є вільним радикалом.
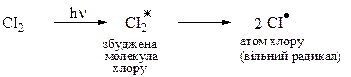
Друга стадія — ріст ланцюгаполягає увзаємодії атомарного хлору з метаном. Ця стадія є найповільнішою і тому визначає швидкість самого процесу. Утворений метильний вільний радикал далі взаємодіє з молекулою хлору, даючи хлорометан і новий атом хлору, що продовжує процес.
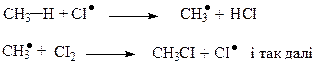
Третя стадія — обрив ланцюга здійснюється при рекомбінації (сполученні) двох будь-яких вільних радикалів.

Хлорування може протікати далі з утворенням ди-, три- і тетрахлорометану.
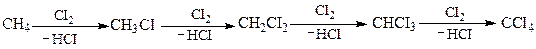
При хлоруванні алканів складнішої будови утворюється суміш монохлоропохідних:
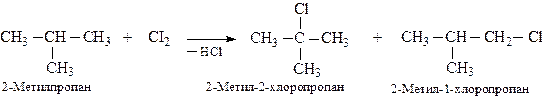
Найлегше галогеном заміщується водень біля третинного атому вуглецю, потім – біля вторинного і, найважче, — біля первинного. Тобто, реакція протікає регіоселективно. Співвідношення швидкостей заміщення водню біля первинного, вторинного і третинного атомів вуглецю можна оцінити як 1:4:5 — при хлоруванні і як 1:200:2000 — при бромуванні. Отже, бромування протікає хоч і повільніше, але з більшою регіоселективністю.
2. Нітрування.
Процес нітрування полягає у введенні в сполуку нітрогрупи (―NO2). Для цього найчастіше використовують нітратну кислоту (HNO3).
Концентрована нітратна киcлота, діє на алкани тільки при високій температурі і, виключно, як окиснювач. У 1888 р. М.Коновалов запропонував застосовувати для нітрування алканів розведену (10-14 %) нітратну кислоту при температурі її кипіння.
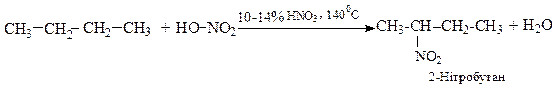
Однак, швидкість рідкофазного нітрування невелика, а вихід нітроалканів дуже низький.
Хасс (1936 р.) запропонував нітрувати алкани в газовій фазі при температурі 300-500oС. Реакція протікає за вільнорадикальним механізмом, який, однак дещо відрізняється від механізму галогенування алканів:
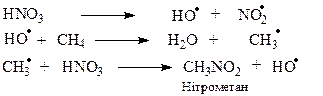
Однак, і в цьому випадку вихід нітрометану не перевищує 35%. Основна причина низького виходу нітрометану полягає в тому, що при взаємодії метильного вільного радикалу з нітратною кислотою утворюється, в основному, не нітрометан, а метанол за схемою:
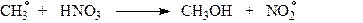
З цієї причини нітрування алканів не набуло практичного значення і сьогодні в промисловості майже не використовується.
При нітруванні інших алканів легкість заміщення водню у вуглецевих атомів, як і при галогенуванні зростає в ряді:
первинний < вторинний < третинний
Часто процес супроводжується розривом зв‘язків С—С, що видно з аналізу складу продуктів нітрування пропану:
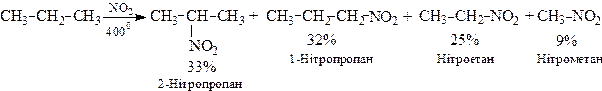
3. Реакції сульфохлорування та сульфоокиснення.
Алкани за звичайних умов стійкі до дії сульфатної кислоти. При нагріванні сульфатна кислота виступає як окиснювач. Тому перспективними методоми одержання сульфопохідних є сульфохлорування і сульфоокиснення.
2.1. Сульфохлорування. (Рід і Хорн, 1936).
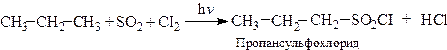
Реакція протікає за механізмом SR на світлі або у присутності речовин, які утворюють вільні радикали.
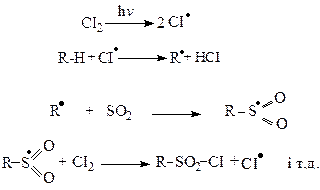
У реакцію фотохімічного сульфохлорування вступають всі вуглеводні, починаючи з метану, при кімнатній температурі. Атоми водню, що зв’язані з вторинними вуглецевими атомами заміщуються легше ніж ті, що зв’язані з первинними. Водні біля третинного вуглецю на сульфохлоридну групу не заміщуються, мабуть внаслідок просторових труднощів.
Алкансульфохлориди при взаємодії з лугами утворюють солі сульфокислот, які застосовують, як миючі засоби і поверхнево-активні речовини (ПАР).
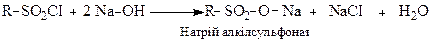
R = C10 – C20
3.2. Сульфоокисненнязастосовується для одержання алкансульфокислот.
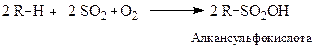
Механізм реакції також вільнорадикальний.
Реакції розщеплення
1. Дегідрування алканів (розщеплення зв’язку С-Н, тобто відщеплення водню) дозволяє з насичених вуглеводнів одержати ненасичені:
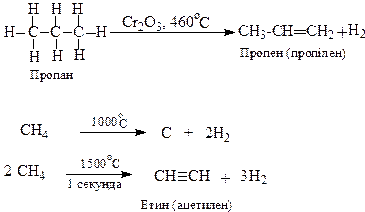
Розщеплення зв’язків С-С, має місце при крекінгу вуглеводнів.
2. Крекінг алканів
Крекінгом називається термічне перетворення алканів при температурі 470-540оС. Розрізняють термічний і каталітичний крекінг.
Головними процесами при крекінгу є розрив (деструкція) вуглеводневого ланцюга за зв’язками С—С з одночасним дегідруванням, ізомеризацією та циклізацією. В результаті крекінгу утворюються, головним чином, ненасичені вуглеводні. Будова кінцевих продуктів крекінгу визначається:
1) природою вихідного алкана, 2) умовами процесу (температура, тиск, час, каталізатор).
Початкова температура розщеплення вуглецевого скелету алканів залежить від їх молекулярної маси. Чим вона більша, тим нижча температура потрібна для розщеплення алканів. Існують такі тенденції розриву зв’язку С—С: з підвищенням температури спостерігається зміщення місця розриву до краю ланцюга, з підвищенням тиску ланцюг розривається ближче до середини.
2.1. Термічний крекінг буває рідкофазним та газофазним. Це вільнорадикальний процес, в результаті якого утворюється, як правило суміш насичених і ненасичених вуглеводнів. При температурі 470-550o алкани розкладаються на вільні радикали, які, в свою чергу, здатні піддаватись подальшим перетворенням.
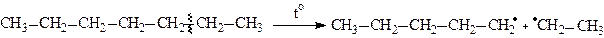
Для утворених вільних радикалів характерні такі реакції: β-розпаду та диспропорціонування.
Pеакція β-розпаду:
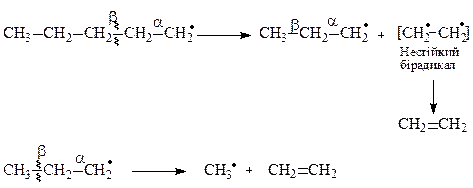
Реакції β-розпаду вільних радикалів є основною причиною утворення великої кількості етилену при термічному крекінгу вуглеводневої сировини.
Реакція диспропорціонування— це реакція β-розпаду за С—Н-зв’язком. Але атомарний водень, що утворився би в результаті цієї реакції має дуже високу енергію і тому його відщеплення може протікати тільки при взаємодії з іншим вільним радикалом, який приєднує цей атом водню. В результаті утворюється ненасичений і насичений вуглеводні
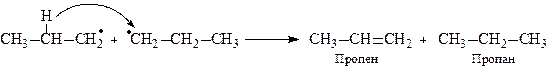
Розпад і диспропорціонування вільних радикалів відбувається за β-зв’язком відносно атома вуглецю з неспареним електроном, тому що β-зв’язок до певної міри розрихлений за рахунок ефекту гіперкон’югації.
Перетворення алканів при температурі вище 550оС називається піролізом і супроводжується глибоким руйнуванням структури алкану.Наприклад, при піролізі бутану утворюються такі продукти:
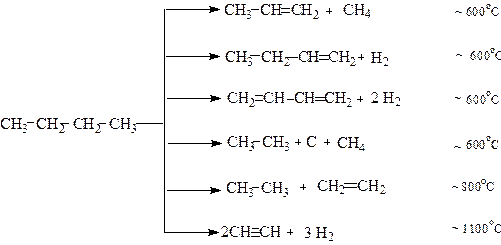
2.2. 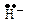 Каталітичний крекінг застосовують, головним чином, з метою одержання розгалужених алканів та алкенів. Процес проходить у присутності алюмосилікатних каталізаторів або AlCl3 при 450-530оС. Реакція починається з відщеплення гідридйона ( ) від алкана з утворенням карбокатіона:
Каталітичний крекінг застосовують, головним чином, з метою одержання розгалужених алканів та алкенів. Процес проходить у присутності алюмосилікатних каталізаторів або AlCl3 при 450-530оС. Реакція починається з відщеплення гідридйона ( ) від алкана з утворенням карбокатіона:
2.3.
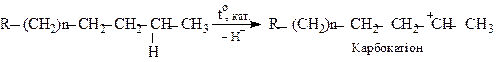
Утворений карбокатіон зазнає β-розпаду, що і призводить до розщеплення вуглецевого ланцюга
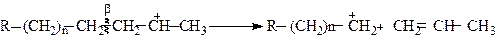
Стабілізація утворених карбокатіонів можлива за однією із реакцій:
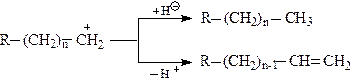
Паралельно проходять реакції ізомеризації карбокатіонів нормальної будови, в результаті чого утворюються стабільніші третинні карбокатіони, наприклад:
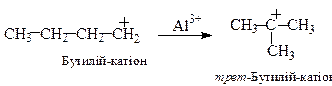
Такі карбокатіони стабілізуючись утворюють розгалужені алкани:
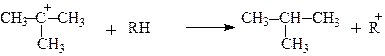
Одержані за допомогою каталітичного крекінгу розгалужені вуглеводні є цінними високооктановими бензинами.
Поняття про детонаційну стійкість і октанове число моторних палив.
У двигуні внутрішнього згорання суміш бензинової пари з повітрям всмоктується в циліндр і там стискається під час такту стискання. При стисканні температура суміші підвищується і компоненти бензину починають реагувати з киснем повітря, утворюючи пероксиди, які одразу розкладаються з вибухом і викликають передчасне загорання і навіть вибух робочої суміші. Це явище називається детонацією і наносить велику шкоду двигуну.
Найсильніше детонують алкани нормальної будови. Розгалужені алкани позбавлені цього недоліку. Особливо цінні в цьому відношенні вуглеводні з неоструктурою типу ізооктану:
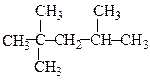
2,2,4-Триметилпентан (“ізооктан”)
Здатність моторного палива витримувати стискання в суміші з повітрям без передчасної детонації називається детонаційною стійкістю палива. Кількісною мірою детонаційної стійкості може служити октанове число моторного палива.
Ізооктану, який характеризується високою детонаційною стійкістю, умовно присвоєно октанове число 100, а н-гептану – 0 (дуже низька детонаційна стійкість).
Якщо бензин має октанове число 92, наприклад, А-92, то це означає, що він має таку саму детонаційну стійкість, як суміш 92% ізооктану і 8% н-гептану.
Паливо для дизельних двигунів характеризується “цетановим числом“. Тут, навпаки, найцінніші сорти палива складаються з алканів нормальної будови (цетанове число гексадекана (цетана) СН3-(СН2)14-СН3 прийняте за 100).
Окиснення алканів
Такі традиційні окисники, як KMnO4, K2Cr2O7 тощо на алкани, переважно, не діють Алкани окиснюються киснем повітря при 110-190о в присутності кобальтового каталізатора. Це так зване аутоокиснення алканів. Механізм реакції вільнорадикальний. При дії високих температур за рахунок відщеплення атомів водню або розриву зв’язку С─С утворюються алкільні вільні радикали (R•), які приєднують молекулу кисню з утворенням пероксильних радикалів:
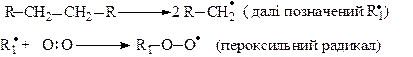
Пероксильний радикал R1-O-O• віщеплює атом водню від іншої молекули алкану і перетворюється на гідропероксид.
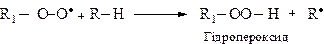
Найлегше атоми водню відділяються від третинного атома вуглецю, потім від вторинного і найважче — від первинного.
В умовах реакції окиснення гідропероксиди розпадаються на вільні радикали за зв’язком -О-О-.

Вільні радикали, в свою чергу, вступають у різні реакції з утворенням алканів або ряду кисневмісних сполук: спиртів, альдегідів, тощо.
Склад продуктів розпаду визначається природою утвореного гідропероксиду. Так, первинні гідропероксиди утворюють первинні алкоксирадикали, що в умовах реакції перетворюються за схемою:
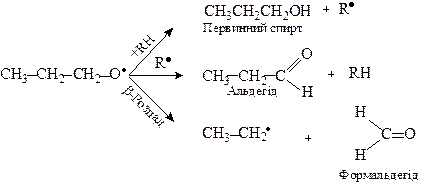
Вторинні гідропероксиди утворюють при розпаді спирти, альдегіди та кетони:
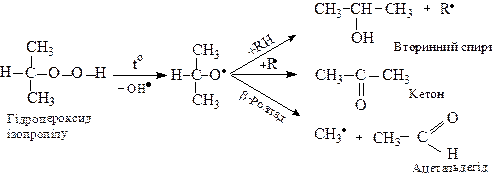
Третинні гідропероксиди при розпаді утворюють третинні спирти і кетони.
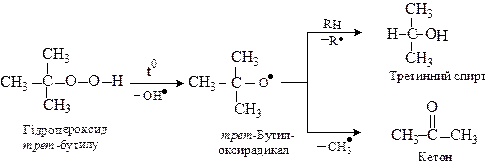
Продукти розпаду - альдегіди і первинні спирти в умовах реакції окиснюються до відповідних кислот:
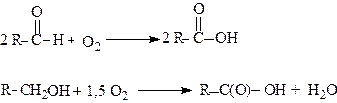
Таким чином, при окисненні алканів утворюються, в основному, карбонові кислоти з домішками кетонів та спиртів.
Промислове значення має процес окиснення бутану в оцтову кислоту, 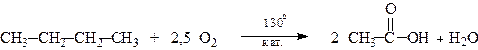
а також окиснення фракції С10-С20 перегонки нафти з утворенням суміші синтетичних жирних кислот (СЖК). Ця суміш використовується для виробництва господарського мила.
Основні шляхи промислового використання метану
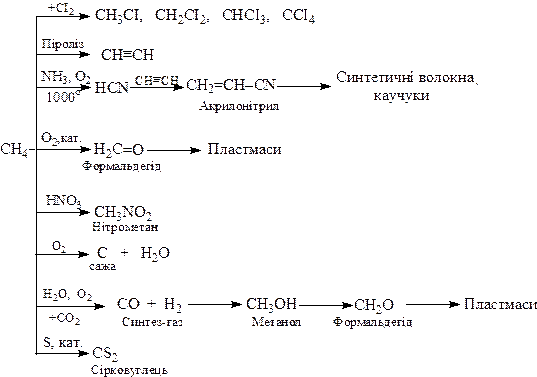
| <== предыдущая лекция | | | следующая лекция ==> |
| ХIМIЧНI ВЛАСТИВОСТI | | | Окиснення сильними окисниками |
Дата добавления: 2016-02-11; просмотров: 2184;
