Окиснення сильними окисниками
Галогенування
До алкенів легко приєднуються галогени з утворенням насичених дигалогенопохідних
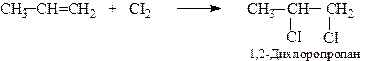
Швидкість приєднання залежить від природи галогену і будови алкену. Фтор реагує зі спалахом, дуже екзотермічний процес. Хлор легко вступає в реакцію приєднання при кімнатній температурі (на світлі з вибухом). Бромування вимагає нагрівання, а йодування здійснюється важко. Залежно від умов реакції, приєднання галогенів відбувається за йонним або радикальним механізмами.
При йонному приєднанні спочатку утворюється π-комплекс (комплекс з перенесенням заряду або скорочено КПЗ), у якому відбувається зміна електронної густини молекул, що беруть участь у його утворенні. В результаті утворюється електрофільна частинка галогена, наприклад, Сl+, яка реагує з етеном, утворюючи карбокатіон або хлоронієвий йон:
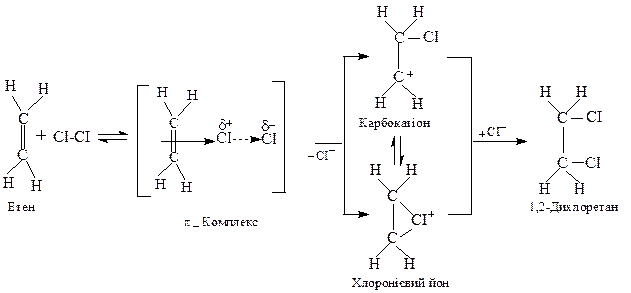 Переважно, в реакціях галогенування утворення циклічного галогенонієвого йона є характерним для простих алканів, а карбокатіона - для арилзаміщених алканів (арили - залишки бензену та його гомологів), оскільки наявність бензенового ядра сприяє стабілізації карбокатіона.
Переважно, в реакціях галогенування утворення циклічного галогенонієвого йона є характерним для простих алканів, а карбокатіона - для арилзаміщених алканів (арили - залишки бензену та його гомологів), оскільки наявність бензенового ядра сприяє стабілізації карбокатіона.
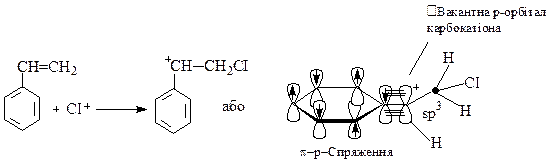
У випадку радикального приєднання галогенів (АR), реакція відбувається таким чином:

1,2-Диброметан
3. Гідрогалогенування - приєднання галогеноводнів.
Алкени реагують з галогеноводнями з утворенням відповідних алкілгалогенідів. Реакційна здатність галогеноводнів зростає в ряді HF < HCI < HBr < HI, який збігається з рядом зростання сили галогеноводневих кислот. Приєднання НF часто супроводжується одночасною полімеризацією алкенів. Реакція відбувається як за АЕ, так і AR механізмами. Напрям приєднання галогеноводнів часто залежить від умов реакції та від будови алкену. Електрофільне (АE) приєднання галогеноводнів проходить через ряд стадій. Спочатку утворюється йонна пара, яка перетворюється на карбокатіон. Карбокатіон легко приєднує нуклеофіл (Br−), даючи молекулу брометану:
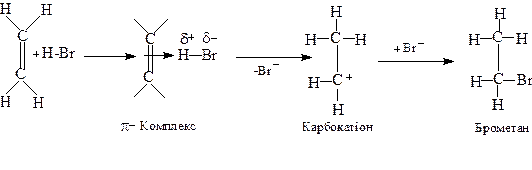 За За правилом В.В.Марковнікова, у випадку приєднання галогеноводнів до несиметричних алкенів, водень приєднується до найбільш «гідрованого» ненасиченого атома вуглецю, тобто, до того, у якого більше атомів водню:
За За правилом В.В.Марковнікова, у випадку приєднання галогеноводнів до несиметричних алкенів, водень приєднується до найбільш «гідрованого» ненасиченого атома вуглецю, тобто, до того, у якого більше атомів водню:
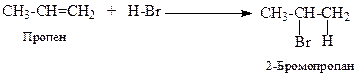
Воно реалізується при йонному механізмі реакції (АE). Це можна пояснити, розглядаючи стабільність проміжних карбокатіонів. Інтермедіат (1) вторинний карбкатіон буде стабільнішим ніж (2) за рахунок кращої делокалізації його позитивного заряду:
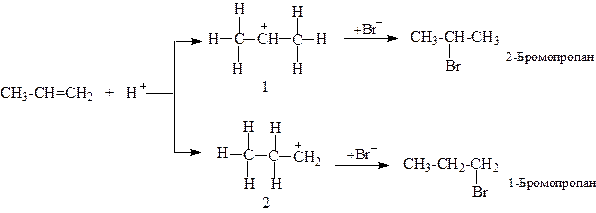
Вільна 2р-орбіталь вторинного атома вуглецю (1) буде вступати в надспряження (σ, р-спряження) з шістьма електронними хмарами β-С―Н-зв’язків, тоді, як первинний карбокатіон (2) делокалізує позитивний заряд за рахунок надспряження лише з двома β-С―Н-зв’язками. Стабілізучим фактором карбокатіонів виступає також +І-ефект. Дві метильні групи карбокатіону (1) проявляють сильніший +І-ефект, ніж одна етильна група в (2).
Отже, карбокатіон (1) буде стабільнішим, ніж (2), а значить його утворення вимагатиме меншої енергії активації і реакція протікатиме переважно через стадію утворення (1), а не (2). В результаті, основним продуктом реакції буде 2-бромопропан, а не 1-бромопропан.
Правило Марковнікова не виконується у випадку наявності при подвійному зв’язку електроноакцепторних груп:
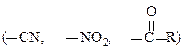
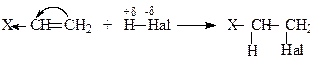
де Х =
Пероксидний ефект М.Караша (1933).При радикальному механізмі приєднання галогеноводнів завжди відбувається проти правила Марковнікова. Цей механізм реалізується в присутності пероксиду водню.
На першій стадії утворюється атомарний бром, який є вільним радикалом:

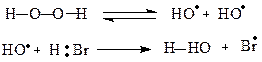
Його приєднання до молекули алкену веде до утворення двох алкільних радикалів (1) або (2).
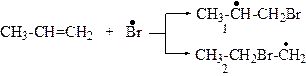
Вільний радикал (1) є стабільнішим, ніж (2) через спряження його неспареного електрона з електронними хмарами п’яти β-С─H-зв’язків так, як у попередньому випадку. Тому утворення радикала (2) малоймовірне, отже:
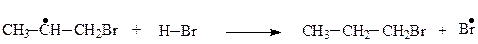
1-Бромопропан
Приєднання всупереч правила Марковнікова називається ефектом Караша. Пероксидний ефект Караша проявляється лише для HBr і частково для НСl, оскільки HF і НI пероксидами на вільні радикали не розкладаються.
4. Гідратація алкенів відбувається у присутності кислот за правилом Марковнікова
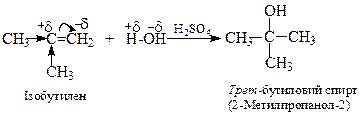
Механізм реакції гідратації:
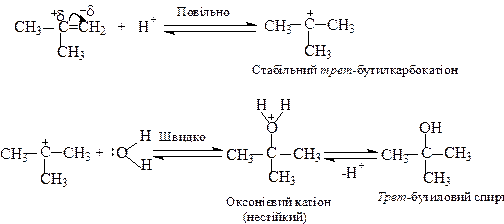
У випадку етилену, реалізується інший механізм. Етилкарбокатіон характеризується низькою стабільністю і тому його утворення малоймовірне. При взаємодії з концентрованою H2SO4 етилен утворює етилсульфат:

Етилсульфат далі гідролізується до етилового спирту і H2SO4.
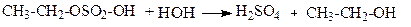
Розроблені економічно вигідніші методи гідратації на твердих каталізаторах без H2SO4:
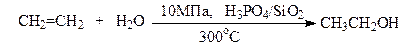
Реакції окиснення
Алкени легко окиснюються і залежно від природи окиснювача та умов реакції утворюють різні продукти.
1. Окиснення водним розчином KMnO4 (реакція Е.Е.Вагнера, 1888 р.).
При окисненні алкенів розведеними водними розчинами KMnO4 у лужному середовищі утворюються гліколі:
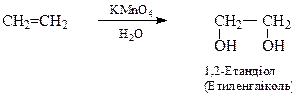
Окиснення сильними окисниками
Під дією сильніших окиснювачів (CrO3, HNO3, KMnO4(конц.), K2Cr2O7) відбувається розрив подвійного зв’язку з утворенням кислот та кетонів за схемою:
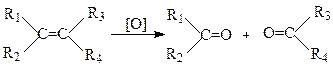
Де R – алкільний радикал або водень.
Якщо в результаті реакції утворюється альдегід, то він окиснюється далі до відповідної карбонової кислоти.

3. Окиснення алкенів молекулярним киснем протікає різними шляхами, залежно від умов реакції.
3.1. Без каталізатора - окиснення напрямлене на розрив β-С-Н-зв’язку з утворенням гідропероксидів, які далі розпадаються на спирти та альдегіди.

3.2. У присутності каталізаторів одержують органічні оксиди (епоксиди)
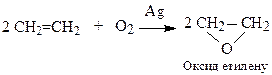
Аналогічні продукти утворюються і при окисненні органічними пероксидами (реакція М.Прилєжаєва)
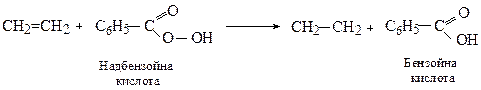
3. Окиснення озоном (озонування за Гаррієсом)
Реакцію озонування використовують для встановлення будови алкенів тому, шо вона завжди протікає селективно за місцем подвійного зв'язку з утворенням пероксиду водню, та карбонільних сполук (альдегідів або кетонів).
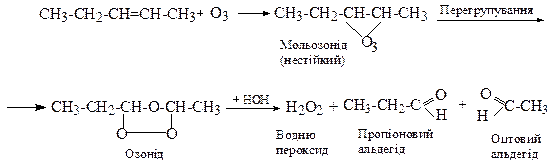
4. Окиснення в присутності солей паладію
Окиснення алкенів в присутності солей Pd (II) і води також приводить до утворення карбонільних сполук типу альдегідів або кетонів, але за іншою схемою:
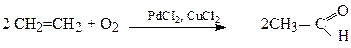
Окиснювачем у цій реакції виступає Pd (II), перетворюючись у Pd (0), який за допомогою CuCl2 регенерується у сіль Pd (II), яка здатна окисненюватися далі:


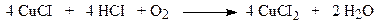
Таким чином, ні PdCI2, ні CuCI2 у цьому процесі не втрачається.
Реакції заміщення
Цей тип реакцій не є характерним для алкенів і є винятком, вони протікають за участю β-С-Н-зв’язків.
До такого типу відноситься т.з. «реакція аномального хлорування пропену»:
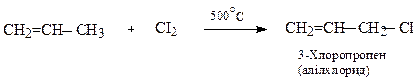
До цих реакцій слід віднести і окиснення алкенів молекулярним киснем (п.3).
Реакції полімеризації
Молекули алкенів здатні приєднуватися одна до одної через розщеплення π-зв'язків з утворенням димерів, тримерів тощо (реакція олігомеризації), або полімерів (реакція полімеризації).
Полімери характеризуються великою молекулярною масою і відносяться до високомолекулярних сполук (ВМС). Їх молекулярна маса рівна кільком десяткам і, навіть, сотням тисяч а.о.м. До ВМС відносяться сполуки, молекулярна маса яких перевищує 20000 а.о.м. У випадку утворення сполук молекулярної маси 500-20000, реакція називається олігомеризацією
Реакцією полімеризації з етилену синтезують поліетилен за схемою:
n СН2= СН2 → (─СН2─СН2─)n
Етилен Поліетилен
(мономер) (полімер)
Аналогічно отримують поліпропілен, поліізобутилен, тощо:
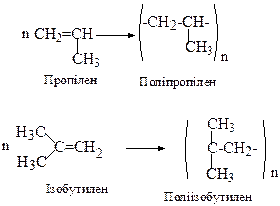
Фрагмент, що багаторазово повторюється в макромолекулі, називається елементарною ланкою полімеру, а середнє число повторень п – ступенем полімеризації. Так, для поліпропілену:
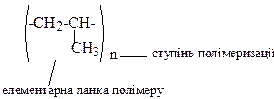
Процеси полімеризації здійснюються, в першу чергу, під впливом ініціаторів або каталізаторів, а також при нагріванні або під дією електромагнітного випромінювання. Залежно від природи активних проміжних частинок, що утворюються в ході процесу (карбокатіони, карбаніони, вільні радикали)– розрізняють йонну (катіонну та аніонну) і радикальну полімеризацію.
На здатність мономера полімеризуватися за тим чи іншим механізмом впливає його хімічна будова і, в першу чергу, природа замісників при подвійному зв'язку. Так, встановлено, що електронодонорні замісники (+I-, +М-еф.) збільшують електронну густину на С=С зв’язку і, особливо, на кінцевому атому вуглецю:
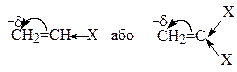
Х= АІк, (-СН3, -С2Н5, тощо), Ar (-C6H5, -C6H4CI), -CH=CH2,
OR (-OCH3, -OC2H5, тощо), -CH2CI.
Електроноакцепторні замісники (-I, -М-еф.), навпаки, зменшують електронну густину на кінцевому атомі вуглецю
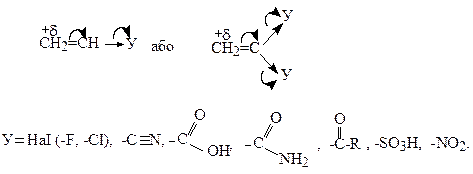
У першому випадку зростає реакційна здатність мономеру по відношенню до катіонних каталізаторів полімеризації, а в другому - до аніонних. Разом з тим, в обох випадках мономери легше вступають у радикальну полімеризацію, ніж незаміщений етилен.
Крім того, значний вплив на швидкість полімеризації спричиняють замісники за рахунок прояву свого М-ефекту, внаслідок спряження π-електронів подвійного зв'язку з р-орбіталями замісника. Це викликає зменшення ступеня перекриття р-орбіталей і π-зв'язку між собою, що сприяє розщепленню його в реакціях полімеризації. У випадку реалізації радикального механізму полімеризації, це сприяє частковій делокалізації неспареного електрону, що підвищує стабільність радикалів. Тобто, М-ефект збільшує реакційну здатність вінільного мономеру в реакціях полімеризації.
Радикальна полімеризація, що протікає:
· у присутсності ініціаторів називається ініційованою полімеризацією;
· під впливом УФ-променів - фотополімеризація;
· α, β- та γ-випромінювання - радіаційна полімеризація;
· нагрівання - термічна полімеризація.
Реакція полімеризації складається з трьох головних стадій, загальних для вільнорадикальних процесів. Розглянемо механізм ініційованої радикальної полімеризації. Ініціаторами полімеризації, як правило, виступають органічні пероксиди або деякі аліфатичні азосполуки.
Перша стадія - ініціювання ланцюга: при слабкому нагріванні ініціатор гомолітично розпадається з утворенням вільних радикалів.
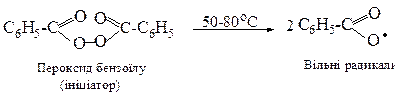
В загальному вигляді цю реакцію можна записати так:
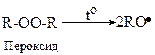
Далі утворений радикал приєднує молекулу мономеру:
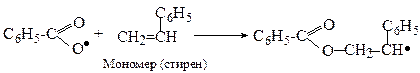
або скорочено
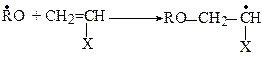
Друга стадія - ріст ланцюга:
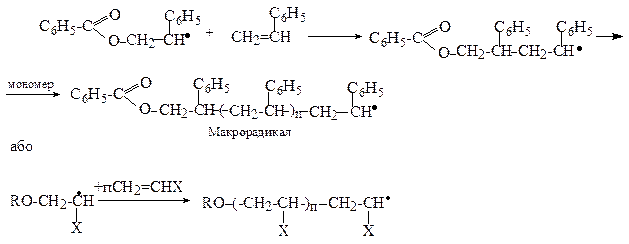
Третя стадія - обрив ланцюга може протікати як за рахунок рекомбінації макрорадикалів, так і шляхом їх диспропорціювання.
Рекомбінація:
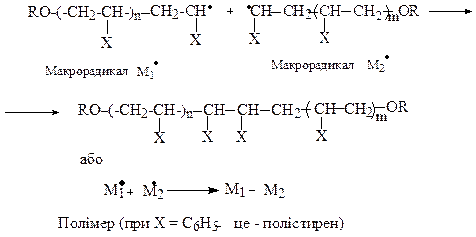
Диспропорціонування
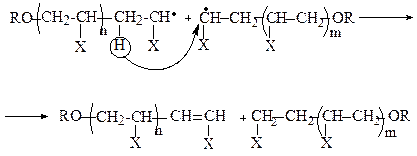
Для одержання полімерів з невисокою молекулярною масою застосовують метод теломеризації.
Теломеризація - полімеризація ненасичених сполук у присутності речовини - передавача ланцюга (телогена). У результаті утворюється суміш олігомерів (теломерів), на кінцях ланцюгів яких знаходяться залишки телогена. Часто телогеном виступає тетрахлорометан ССl4.
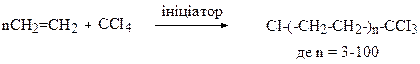
2. Катіонна полімеризація протікає через стадію утворення карбокатіонів під дією каталізаторів електроноакцепторного типу протонних кислот (H2SO4, HCІO4, H3PO4, HCІ), апротонних кислот або каталізаторів Фріделя-Kрафтса (BF3, AІCl3, SnCl4, тощо). Часто використовують співкаталізатор та інші протоногенеруючі сполуки. До катіонної полімеризації схильні алкени з електронодонорними замісниками при подвійному зв’язку.
Ініціювання ланцюга полягає в утворенні сильної кислоти, здатної віддавати протон молекулі мономера
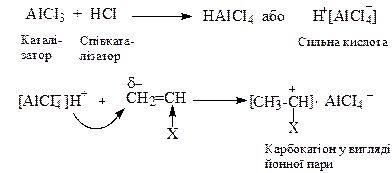
Ріст ланцюга здійснюється за рахунок послідовного входження поляризованої молекули мономера між іонною парою.
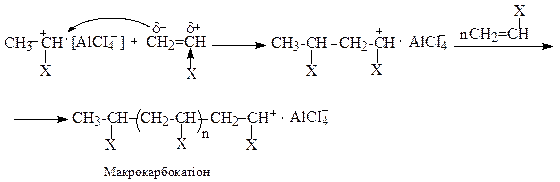
Обрив ланцюга відбувається в результаті відщеплення кислоти від макрокарбокатіона:
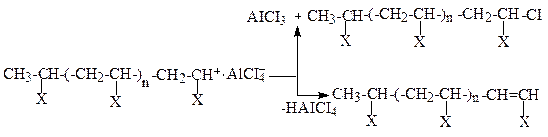
Окремим випадком катіонної полімеризації є реакція димеризації ізобутилену в присутності ізобутану (2-метилпропану) і сульфатної кислоти:
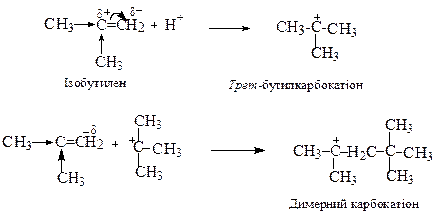
Обрив ланцюга здійснюється внаслідок відриву атома водню від ізобутану димерним карбокатіоном (міжмолекулярне перенесення гідрид-йону).
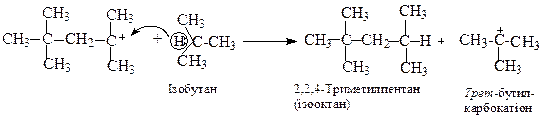
Утворений трет-бутилкарбокатіон знову приєднується до ізобутилену і процес повторюється.
Ця реакція застосовується для одержання високооктанового моторного палива. Октанове число ізооктану дорівнює 100.
Методом катіонної полімеризації у промисловості одержують поліізобутилен і бутилкаучук (продукт спільної полімеризації ізобутилену з 2-4 % ізопрену).
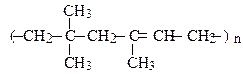
3. Аніонна полімеризація протікає під дією електронодонорних каталізаторів (основи, лужні метали, LiH, NaH, KNH2, Al(C2H5)3, тощо). До аніонної полімеризації схильні алкени з електроноакцепторними замісниками при подвійному зв’язку.
Ініціювання ланцюга
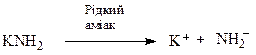
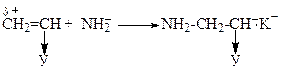
Ріст ланцюга
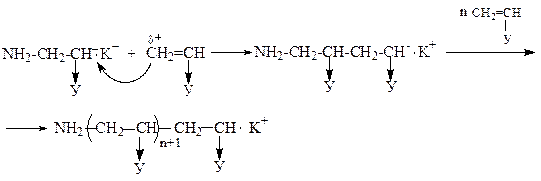
Обрив ланцюга протікає через передачу реакційного центра на розчинник або мономер:
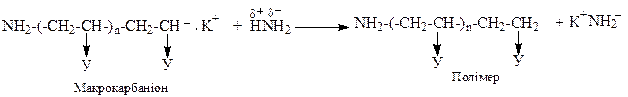 У випадку ініціювання металоалкілами або лужними металами реакцію аніонної полімеризації можна представити у вигляді:
У випадку ініціювання металоалкілами або лужними металами реакцію аніонної полімеризації можна представити у вигляді:
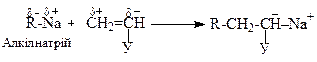 і так далі
і так далі
Крім перерахованих типів полімеризації важливе значення має полімеризація у присутності металоорганічних каталізаторів (каталізаторів К.Циглера, Дж.Натта), яка протікає за складним механізмом (стереоспецифічна полімеризація). При цьому утворюються полімери з регулярною будовою макромолекул – т.з. стереорегулярні полімери.
При звичайних способах полімеризації одержують нестереорегулярні, т.з. атактичні полімери. В їх макромолекулах просторова конфігурація фрагментів елементарних ланок носить випадковий характер.
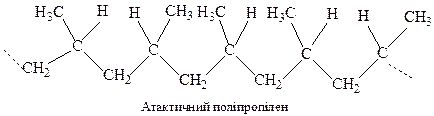
Так, в атактичному поліпропілені нема закономірності в розташуванні груп –СН3 відносно полімерного ланцюга.
В стереорегулярних полімерах така закономірність існує.
Розрізняють 2 види стереорегулярних полімерів: ізотактичні та синдіотактичні. В ізотактичних полімерах всі елементарні ланки мають однакову просторову конфігурацію:
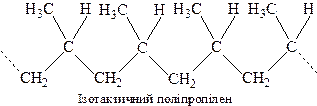
В синдіотактичних – просторова конфігурація елементарних ланок чергується.
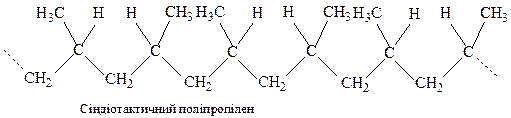
Із алкенів найбільше практичне значення мають етилен, пропілен, ізобутилен та інші.
| <== предыдущая лекция | | | следующая лекция ==> |
| З карбонових кислот. | | | ІЗОМЕРІЯ І НОМЕНКЛАТУРА |
Дата добавления: 2016-02-11; просмотров: 2487;
