Назва монокарбонових ненасичених кислот
| Формула | Номенклатура | ||
| Замісникова | Тривіальна | ||
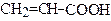
| Пропенова кислота | Акрилова кислота | |
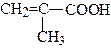
| 2-Метилпропенова кислота | Метакрилова кислота | |
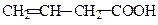
| 3-Бутенова кислота | Вінілоцтова кислота | |
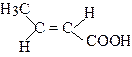
| транс-2-Бутенова кислота | Кротонова кислота | |

| цис-2-Бутенова кислота | Ізокротонова кислота | |
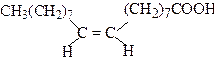
| цис-9-Октадеценова кислота | Олеїнова кислота | |
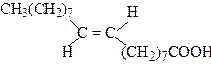
| транс-9-Октадеценова кислота | Елаїдінова кислота | |
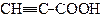
| Пропінова кислота | Пропіолова кислота | |
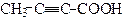
| 2-Бутинова кислота | Тетроловакислота | |

| 9-Октадецинова кислота | Стеаролова кислота | |
Способи одержання
Для одержання монокарбонових ненасичених кислот можна застосовувати практично всі методи добування насичених кислот.
1. Одержання акрилової кислоти
1.1. Окисненням акролеїну киснем повітря
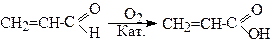
1.2. З ацетилену, шляхом гідролізу акрилонітрилу

Додаючи спирти до акрилонітрилу отримують естери акрилової кислоти, які застосовують для виробництва органічного скла:
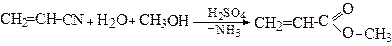
Метилакрилат
З оксиду етилену
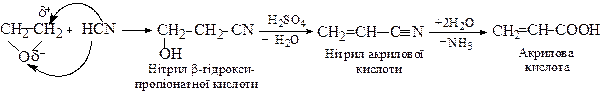
1.4. З ацетилену реакцією оксосинтезу (Реппе, 1944)
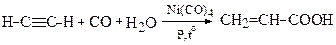
Якщо замість Н2О взяти спирт (метанол), то також утворюється відповідний (метиловий) естер

Метиловий естер
акрилової кислоти
2. Метакрилову кислоту одержують:
2.1. Окиснення ізобутилену киснем повітря

Метакриловий Метакрилова
альдегід кислота
2.2. З ацетонціангідрину
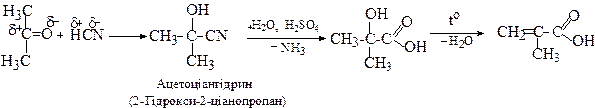
За допомогою реакції зі спиртами з ацетонціангідрину одержують естери метакрилової кислоти
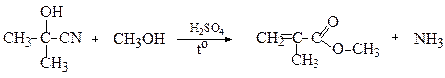 Метилметакрилат
Метилметакрилат
3. Кротонову кислоту одержують при окисненні кротонового альдегіду.
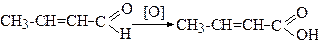
Ізокротонова кислота - цис-ізомер - нестійкий і під дією світла або при нагріванні легко переходить у стабільнішу кротонову кислоту (транс-ізомер).
4. Олеїнова кислота (цис-ізомер) входить до складу рослинних олій у вигляді естерів гліцеролу. Наприклад, оливкова олія містить до 85% триолеату гліцеролу.
Олеїнову кислоту отримують гідролізом рослинних олій за аналогією з гідролізом жирів.
ХІМІЧНІ ВЛАСТИВОСТІ
За карбоксильною групою ненасичені кислоти утворюють солі, ангідриди, галогенангідриди, аміди, естери тощо.
За подвійним зв'язком ненасичені кислоти вступають у реакції приєднання, окиснення, полімеризації.
1. Приєднання галогеноводнів
Приєднання галогеноводнів до ненасичених кислот, що мають подвійний зв'язок біля другого (рахуючи від карбоксильної групи) атома вуглецю, відбувається всупереч правилу Марковникова, внаслідок поляризації С=С-зв'язку під дією карбоксильної групи
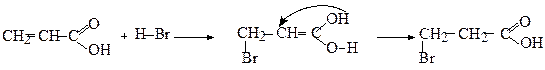
3-Бромопропанова кислота
2. Реакції полімеризації
Естери акрилової та метакрилової кислот (акрилати та метакрилати) легко полімеризуються за радикальним механізмом з утворенням полімерів
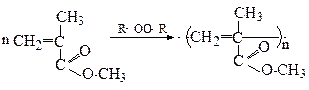
Поліметилакрилат
(органічне скло)
ЖИРИ
Жири - це триацилгліцериди, тобто естери гліцеролу та карбонових кислот, що містять у молекулі від 3 до 18 атомів вуглецю і мають нерозгалужену структуру.
У тверді жири входять залишки насичених кислот, в основному пальмітинової та стеаринової. Рідкі жири (олії) містять залишки ненасичених кислот - олеїнової, лінолевої, ліноленової. Всі ці кислоти називаються вищими жирними кислотами.
При кип'ятінні з водними розчинами лугів жири гідролізуються з утворенням гліцеролу та солей жирних кислот. Ці солі використовуються, як мило, а реакція їх одержання з жирів - омиленням жирів:
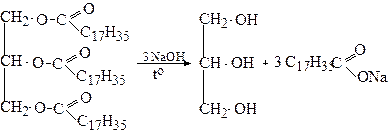
Тристеарат Натрієва сіль
гліцеролу стеаринової кислоти
(мило)
Рослинні олії, що містять гліцериди ненасичених кислот з двома або більше подвійними зв'язками, називаються висихаючими. Вони можуть поглинати кисень повітря, утворюючи гідроксипероксиди і, таким чином, полімеризуються по подвійних зв'язках, утворюючи полімерну плівку. До таких олій відносяться: тунгова, льняна, макова, горіхова, конопляна. До складу їх гліцеридів входять, переважно, залишки лінолевої (9-цис-12-цис-октадекадієнової кислоти, формули:
CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH
та ліноленової (9, 12, 15-цис-октадекатриєнової) кислоти, формули:
СН3-СН2-СН=СН-СН2-СН=СН-СН2-СН=СН-(СН2)7-СООН
Рослинні олії шляхом каталітичної гідрогенізації переводять у тверді жири:
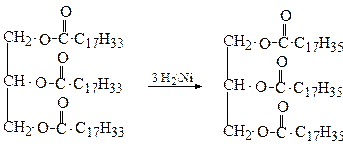
Триолеат гліцеролу Тристеарат гліцеролу
Продукт реакції називається саломасом і є основною складовою частиною маргарину.
У живих організмах жири виконують декілька біохімічних функцій, найголовніша з яких - запасання енергії. При надлишку їжі жири можуть накопичуватися в організмі. Через певний час, під дією ферментів ліпази, вони гідролізуються, а продукти гідролізу засвоюються організмом. Причому, жири - це дуже калорійні продукти. Жири служать також теплоізоляційним матеріалом, що запобігає переохолодженню організма.
Поняття про ліпіди
Ліпідами називають різноманітні природні сполуки, нерозчинні у воді але розчинні у звичайних органічних розчинниках: вуглеводнях, хлоропохідних вуглеводнів тощо. В основному це жири, їх похідні, деякі терпени, наприклад, каротин.
Ліпіди відіграють важливу роль у підтримці структури клітинних мембран. Крім того, порушення процесу обміну ліпідів в організмі веде до такої хвороби, як атеросклероз та інших серцево-судинних захворювань.
Ароматичні Одноосновні карбонові кислоти
Ароматичними карбоновими кислотами називаються сполуки, молекули яких містять карбоксильну групу, зв’язану безпосередньо з бензеновим ядром або з атомом вуглецю у боковому ланцюзі. За числом карбоксильних груп розрізняють монокарбонові кислоти, дикарбонові і так далі, (див.стор.). Назви ароматичних карбонових кислот з карбоксильною групою в ядрі, утворюються від назви бензенкарбонової (бензоатної) кислоти. Збережені також тривіальні назви:
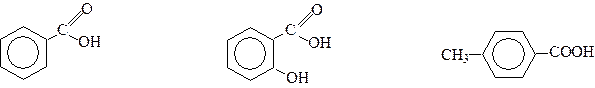
Бензенкарбонова кислота 2-Гідрооксибензенкарбонова 4-етилбензенкарбонова
кислота (бензоатна кислота) (саліцилатна кислота) (п-толуїлатна кислота)
Якщо карбоксильна група знаходится у боковому ланцюзі, то такі кислоти називають, як похідні аліфатичних карбонових кислот.
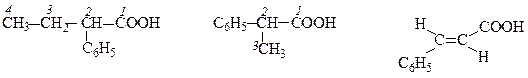
2-Фенілбутанова кислота 2-Фенілпропанова кислота транс-3-Фенілпропенова
- (α-фенілбутиратна) (метилфенілацетатна) кислота (цинамонова)
Способи одержання
1. Реакції окиснення аренів, аренокарбальдегідів та арилкетонів
Толуєн окиснюється киснем повітря при 130-170о у присутності солей Со2+, або розчином KmnO4 при 100о з утворенням бензоатної кислоти.
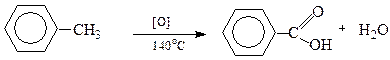
Інші алкіларени при окисненні також утворюють бензоатну кислоту, незалежно від будови алкільної групи (R).
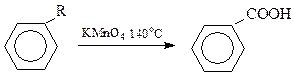
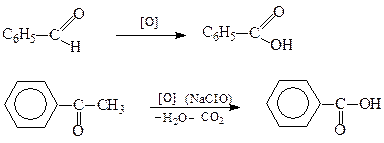
2. Реакції гідролізу
2.1. Гідроліз нітрилів
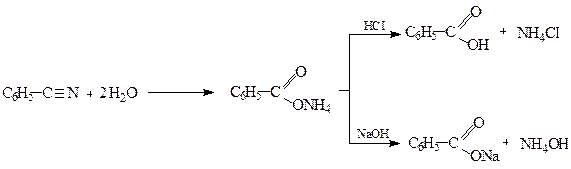
2.2. Гідроліз гем-тригалогенопохідних
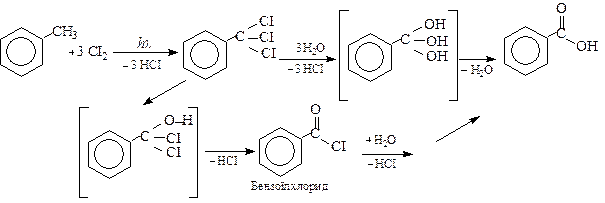
3. Уведення карбоксильної групи за методом Фріделя-Крафтса
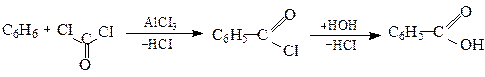
Фосген Хлорангідрид
бензоатної кислоти
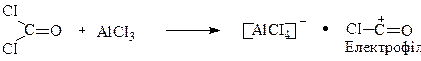
Механізм даної реакції SE, аналогічний до механізму раніше наведених реакцій ацилювання ароматичних вуглеводнів (див.стор.), першою стадією якого є утворення електрофілу:

Фізичні та хімічні властивості
Ареномонокарбонові кислоти є безбарвними кристалічними речовинами.
Розподіл електронної густини бензенового кільця (ядра) визначається електроноакцепторними властивостями карбоксильної групи (замісник ІІ-роду).
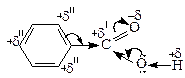 Бензоатна кислота дещо сильніша, ніж оцтова, що пояснюється впливом (-I)-ефекту бензенового кільця.
Бензоатна кислота дещо сильніша, ніж оцтова, що пояснюється впливом (-I)-ефекту бензенового кільця.
Таблиця 1.
Значення констант дисоціації оцтової та деяких ароматичних кислот
| Кислота | Кд | Кислота | Кд |
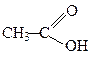 Ацетатна
(оцтова)
Ацетатна
(оцтова)
| 1,76·10-5 | 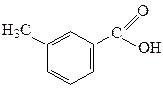 м-Толуїлатна
м-Толуїлатна
| 5,3·10-5 |
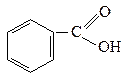 Бензоатна
Бензоатна
| 6,6·10-5 | 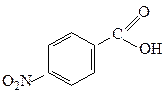 п-Нітробензоатна п-Нітробензоатна
| 3,7·10-4 |
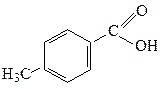 п-Толуїлатна п-Толуїлатна
| 4,2·10-5 |  о-Толуїлатна
о-Толуїлатна
| 1,2·10-4 |
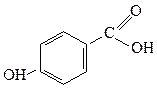 п-Гідроксибензоатна п-Гідроксибензоатна
| 3,3·10-5 | 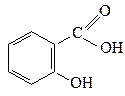 о-Гідроксибензоатна
(Саліцилатна)
о-Гідроксибензоатна
(Саліцилатна)
| 1,1·10-3 |
Електронодонорні замісники (—СН3; —ОН) в м- та п-положеннях по відношенню до карбоксильної групи зменшують силу кислоти, а електроакцепторнні (-NO2), навпаки, збільшують.
Справа в тому, що негативний заряд карбоксилат-аніону (див.стор.), не може бути делокалізований в ароматичному ядрі за рахунок спряження.
Крім того, наявність в о-положенні груп, здатних утворювати водневі зв’язки, сприяє стабілізації карбоксилат-аніону і тим самим підвищує силу кислоти, що видно на прикладі саліцилової кислоти, константа дисоціації якої значно більша від константи дисоціації п-гідроксибензоатної кислоти.
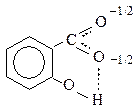
З тої ж причини о-толуїлатна кислота сильніша від п-толуїлатної:
Для аренових кислот характерні всі реакції насичених карбонових кислот (див.стор.).
Утворення солей
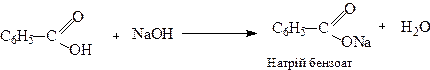
2. Утворення естерів
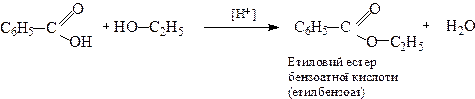
Замісники, введені в о-положення бензенового ядра зменшують швидкість естерифікації. При наявності двох замісників в о-положенні естерифікація не може відбуватися через стеричні перешкоди.
3. Утворення галогенангідридів та ангідридів
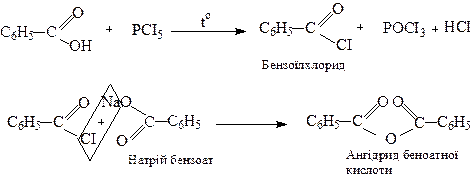
4. Одержання пероксиду бензоїлу
Пероксид бензоїлу – ініціатор радикальної полімеризації (див.стор.) широко застосовується у промисловості.
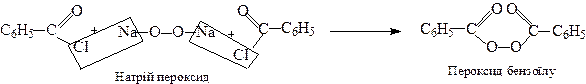
Окремі представники
Бензоатна кислота – безбарвна кристалічна речовина. Її отримують у промисловості окисленням толуєну. Застосовують для синтезу барвників, пахучих та лікувальних речовин.
Фенілацетатну кислоту отримують гідролізом фенілацетонітрилу. Використовують у парфюмерії, а також у виробництві ліків.
Цинамонову кислоту (транс-3-фенілпропенову) одержують реакцією Перкіна (див.стор.) або конденсацією Кляйзена (див.стор.). Застосовують у виробництві пахучих та лікувальних речовин.
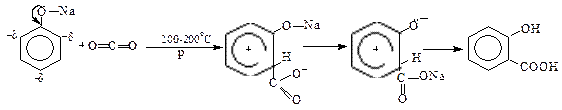
Саліцилатну кислоту (о-гідроксибензоатну) одержують карбоксилюванням з фенолу реакцією Г.Кольбе-Р-Шмідта:
 Саліцилатну кислоту та її похідні використовують у медицині у вигляді натрій саліцилату та інших сполук:
Саліцилатну кислоту та її похідні використовують у медицині у вигляді натрій саліцилату та інших сполук:
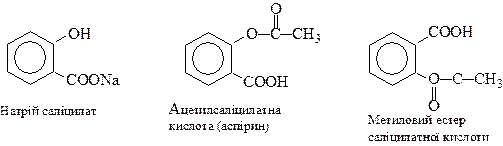
Антранілову кислоту (о-амінобензоатну) – одержують з фталіміду за реакцією А.Гофмана (див.стор.):
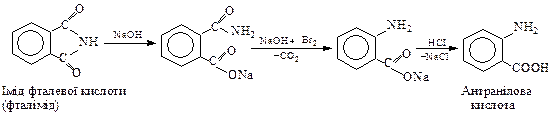
Антранілову кислоту застосовують в аналітичній хімії, парфюмерії.
п-Амінобензоатну кислоту одержують відновленням п-нітробензоатної кислоти
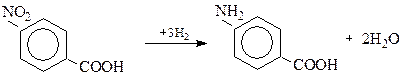
Естери п-амінобензоатної кислоти застосовують у медицині, як знеболюючі засоби:
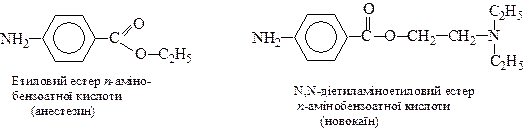
ДИКАРБОНОВІ НАСИЧЕНІ ТА НЕНАСИЧЕНІ КИСЛОТИ
Дикарбонові, або двоосновні кислоти містять у молекулі дві карбоксильні групи. Їх номенклатура аналогічна до номенклатури монокарбонових кислот (табл.3). Але на відміну від одноосновних кислот двоосновні мають суфікс -діова, а не -ова кислота.
Таблиця 3
Дата добавления: 2016-02-11; просмотров: 3027;
