СПОСОБИ ОДЕРЖАННЯ КАРБОНОВИХ КИСЛОТ
Таблиця 1
Назви монокарбонових насичених кислот та їх залишків
| Формула | Номенклатура | ||
| Замісникова | Радикало-функціональна (тривіальнаназва) | ||
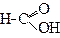
| Метанова кислота | (Мурашина) кислота | |
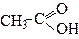
| Етанова кислота | (Оцтова або ацетатна) кислота | |
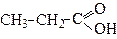
| Пропанова кислота | (Пропіонова або пропіонатна) кислота | |
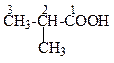
| 2-Метилпропанова кислота | (Ізомасляна або ізобутиратна) кислота | |
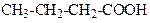
| Бутанова кислота | Масляна або бутиратна) кислота | |
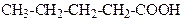
| Пентанова кислота | (Валер`янова) кислота | |
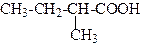
| 2-Метилбутанова кислота | Етилметилоцтова кислота | |
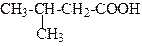
| 3-Метилбутанова кислота | (Ізовалер`янова) кислота | |
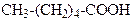
| Гексанова кислота | (Капронова)кислота | |
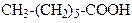
| Гептанова кислота | (Енантова) кислота | |
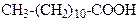
| Додеканова кислота | (Лауринова) кислота | |
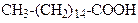
| Гексадеканова кислота | (Пальмітинова) кислота | |
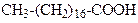
| Октадеканова кислота | (Стеаринова) кислота | |
| Ацильні залишки (ацили) | |||
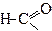
| Метаноїл | Форміл | |
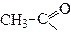
| Етаноїл | Ацетил | |
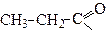
| Пропаноїл | Пропіоніл | |
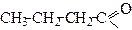
| Бутаноїл | Бутирил | |
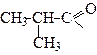
| 2-Метилпропаноїл | Ізобутирил | |
| Ацилоксигрупи (кислотні залишки) | |||
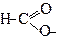
| Метаноат | Форміат | |
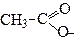
| Етаноат | Ацетат | |
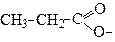
| Пропаноат | Пропіонат | |
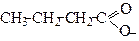
| Бутаноат | Бутират | |
Мурашина кислота міститься у мурашках (опік після укусу). Масляна - має запах старого масла. Капронова - міститься у козячому жирі (лат.caper - коза) тощо. Якщо забрати від молекули карбонової кислоти НО-групу, отримаємо залишок, який називається ацилом (ацильною групою)
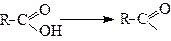
Ацил
 Радикали ацили називають, як за тривіальною назвою кислот, так і за замісниковою наменклатурою. В останньому випадку до назви алкану додають закінчення –оїл (табл.1). Якщо від карбоксильної групи забрати атом водню, отримуємо ацилоксигрупу , яку також можна назвати за радикало-функціональною або замісниковою номенклатурами. У цьому випадку до назви алкану додають закінчення -оат (табл.1).
Радикали ацили називають, як за тривіальною назвою кислот, так і за замісниковою наменклатурою. В останньому випадку до назви алкану додають закінчення –оїл (табл.1). Якщо від карбоксильної групи забрати атом водню, отримуємо ацилоксигрупу , яку також можна назвати за радикало-функціональною або замісниковою номенклатурами. У цьому випадку до назви алкану додають закінчення -оат (табл.1).
СПОСОБИ ОДЕРЖАННЯ КАРБОНОВИХ КИСЛОТ
У промисловості карбонові кислоти одержують, головним чином, такими методами:
Окиснення
1.1. Окиснення алканів киснем повітря або чистим О2.
Процес окиснення, як звичайно, проводять у рідкій фазі у присутності каталізаторів при температурах від 105 до 200оС. При окисненні алканів С4-С8 утворюється, головним чином, оцтова кислота.
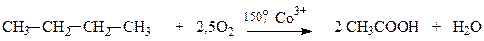
Окиснення фракцій прямогонного бензину С5-С8 призводить до утворення суміші кислот (мурашиної, оцтової, пропіонової). Одержану суміш розділяють на індивідуальні сполуки.
Широко застосовується також процес окиснення твердих алканів (парафіну С10-С20). При цьому утворюються т.з. синтетичні жирні кислоти (СЖК), на основі яких виробляють господарське мило та різні миючі засоби.
1.2. Реакція оксосинтезу (карбонілування)
Реакція карбонілування дозволяє зі спиртів отримувати карбонові кислоти.
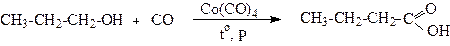
Оксосинтез за участю алкенів, суміші СО та Н2О над Ni(СО)4 при температурах 100-200оС та тиску до 20 Мпа, також призводить до утворення суміші кислот нормальної та ізобудови:
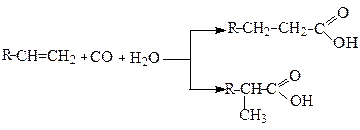
1.3. Окиснення спиртів та альдегідів (див. стор.).
Первинні спирти у присутності каталізаторів при 300-400о оксинюються киснем повітря до відповідних кислот.
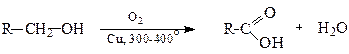
У ролі окисників можна використовувати KMnO4, K2Cr2O7, CrO3 тощо. Альдегіди також доволі легко окиснюються до кислот (див.стор. ).
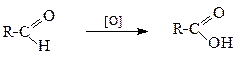
2. Гідроліз
2.1. Гідроліз гемінальних тригалогенопохідних (див. стор.).
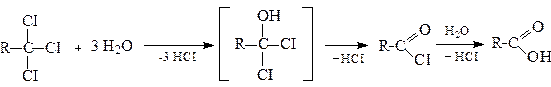
2.2. Гідроліз нітрилів у кислому або лужному середовищах
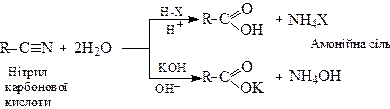
У кислому середовищі утворюється кислота і амонійна сіль, а у лужному – кислота виділяється у вигляді солі.
2.3. Гідроліз естерів і жирів
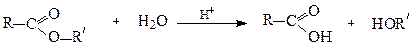
Лужним гідролізом (омиленням) жирів одержують вищі жирні кислоти, переважно стеаринову та пальмітинову:
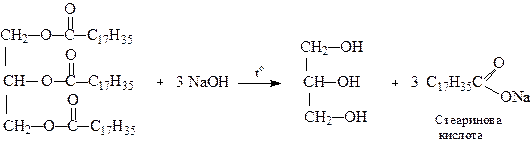
3. Одержання за допомогою металоорганічних сполук
Найкращі виходи дають літійорганічні сполуки.
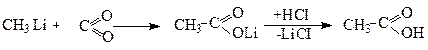
Метиллітій
Використовують також і магнійорганічні сполуки:
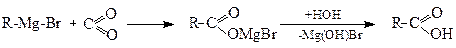
Реактив
Гриньяра
ФІЗИЧНІ ВЛАСТИВОСТІ
Карбонові кислоти С1-С10 - рідини, починаючи з С11 - тверді речовини. Зі збільшенням молекулярної маси, збільшується температура кипіння. Температура плавлення кислот з парним числом атомів вуглецю вища, ніж з непарним. Це пояснюється тим, що у кислот з парним числом атомів вуглецю кінцева СН3-група і -СООН розміщені з різних боків від вісі молекули, внаслідок чого такі молекули активніше взаємодіють між собою:

С4 С5
Для кислот характерні вищі, порівняно зі спиртами, температури кипіння, що пояснюється утворенням циклічних димерів, або лінійних олігомерів за рахунок міцніших водневих зв'язків .
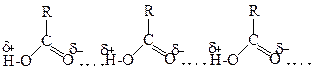
Лінійний олігомер
ХІМІЧНІ ВЛАСТИВОСТІ
У карбоксильній групі зв'язок С=О довший, ніж в альдегідах, а зв'язок С―О коротший, ніж у спиртах. Це свідчить про взаємодію електронних систем С=О групи та атома кисню гідроксильної групи.
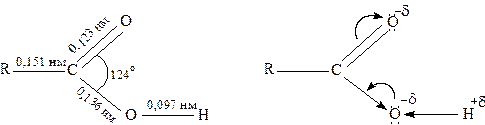
Неподілені електронні пари атомів кисню надають їм нуклеофільних властивостей. Неподілена пара електронів атома кисню ОН-групи вступає у спряження з π-електронами карбонільної групи і виявляє при цьому +М-ефект, що збільшує величину негативного заряду на вуглецевому атомі кисню карбоксильної групи. Крім того, у карбоксильній групі наявні атоми водню і вуглецю, які мають часткові позитивні заряди і можуть виступати як електрофільні центри.
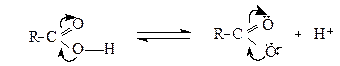
1. Кислотні властивості карбонових кислот
Завдяки високій поляризованості зв'язку О-Н кислоти здатні до дисоціації за схемою
Карбоксилат-йон
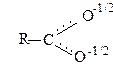 Обидва атоми кисню у карбоксилат-йоні знаходяться на однаковій віддалі від атома вуглецю і електронна густина рівномірно розподілена між ними. Чотири p-електрони делокалізовані мід трьома ядрами атомів кисню і вуглецю.
Обидва атоми кисню у карбоксилат-йоні знаходяться на однаковій віддалі від атома вуглецю і електронна густина рівномірно розподілена між ними. Чотири p-електрони делокалізовані мід трьома ядрами атомів кисню і вуглецю.
Все це робить карбоксилат-йон доволі стійким, тому карбонові кислоти – набагато сильніші кислоти ніж спирти.
Найсильна незаміщена карбонова кислота – метанова. Далі сила кислот поступово зменшується за рахунок прояву +І-ефекту алкільних груп, про що свідчать значення констант дисоціації (Кд).
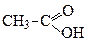
| 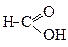
| 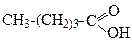
| 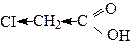
|
| Kд = 21,4 . 10-5 | Kд = 1,76 .10-5 | Kд = 1,50 .10-5 | Kд = 155 . 10-5 |
Сила кислоти зростає, якщо до α-вуглецевого атома приєднана електроноакцепторна група, наприклад, атом галогену, або NO2-група.
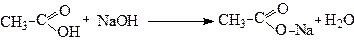
При взаємодії з основами утворюються солі карбонових кислот:
2. Утворення галогенангідридів (ацилгалогенідів)
Галогенангідрид отримують шляхом заміни ОН-групи у карбоксильній групі на атом галогену, при дії на кислоти сильних галогенуючих агентів (РСІ3, PCI5, SOCI2 тощо):
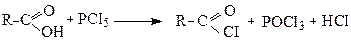
Ацилхлорид
(хлорангідрид
карбонової кислоти)
Атом галогену в них дуже рухливий і легко вступає у реакцію заміщення зі сполуками, які містять атом металу або активний (рухливий) атом водню.
Через це хлорангідриди, являються активними ацилюючими агентами (вони вводять у молекули залишки кислот - ацили) і знаходять широке застосування в органічному синтезі. Реакція ацилювання відноситься до реакцій нуклеофільного заміщення (SN) в хлорангідриді.
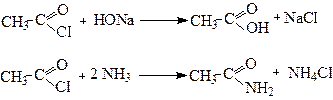
Ацетамід
(амід оцтової кислоти)
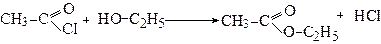
Етилацетат (естер)
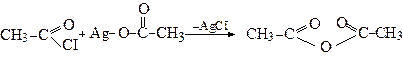
Оцтовий ангідрид
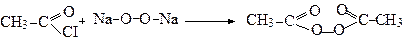
Натрій пероксид Пероксид ацетилу
Більшість таких реакцій відбувається за схемою:
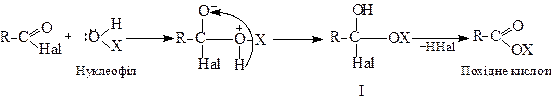
Нуклеофільний реагент (НОР) атакує позитивний атом вуглецю карбоксильної групи, а потім відбувається перехід водню до карбонільного кисню з утворенням проміжного нестійкого аддукту (І), який втрачає галогеноводень, перетворюючись на похідне кислоти.
3. Утворення ангідридів
Ангідриди кислот утворюються при відщепленні молекули води від двох молекул одноосновної кислоти
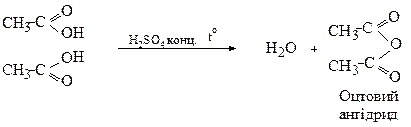
Другий метод (реакція ацилювання) наведений вище.
У промисловості оцтовий ангідрид отримують також через кетен (див.стор. ).
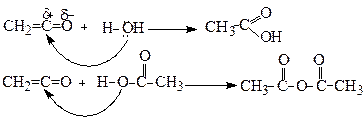
Ангідриди, подібно до хлорангідридів, є активними ацилюючими агентами і легко реагують з речовинами нуклеофільної природи:
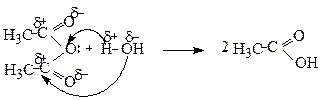
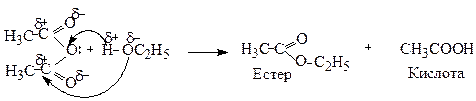
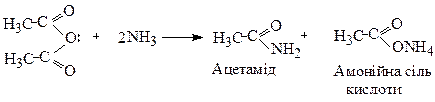
4. Утворення амідів
Аміди утворюються при взаємодії хлорангідридів або ангідридів кислот з аміаком:
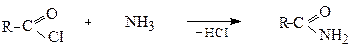
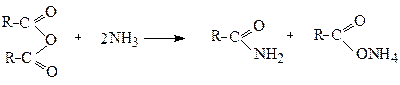
За іншим методом амід одержують дегідратацією при нагріванні амонійної солі:
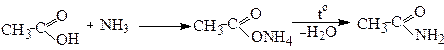
Ацетамід
Для цього суміш парів кислоти і аміаку пропускають над дегідратуючим каталізатором:
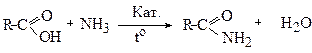
Аміди є також проміжними продуктами при гідролізі нітрилів:
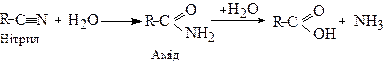
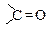 Хімічні властивості амідів зумовлені наявністю двох функціональних груп -NH2 і . При цьому має місце p-π-спряження між неподіленою електронною парою атома азоту і π-зв'язком карбонільної групи. Це викликає зміщення p-електронів атома азоту до карбонільної групи
Хімічні властивості амідів зумовлені наявністю двох функціональних груп -NH2 і . При цьому має місце p-π-спряження між неподіленою електронною парою атома азоту і π-зв'язком карбонільної групи. Це викликає зміщення p-електронів атома азоту до карбонільної групи
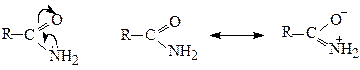
Внаслідок цього електронна густина на атомі азоту зменшується. Тому, аміди є дуже слабкими основами і утворюють солі тільки з сильними мінеральними кислотами, причому, приєднання протону протікає переважно до кисню С═О-групи:
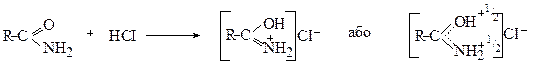
Одночасно аміди проявляють слабкі кислотні властивості і реагують з металічним натрієм з утворенням солей:
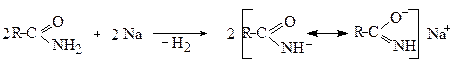
Отже, для амідів можлива внутрішньомолекулярна амідно-імідна таутомерія, де амідна форма енергетично вигідніша:
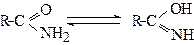
Амідна форма Імідна форма
Нарешті, здатність атома вуглецю карбонільної групи до взаємодії з нуклеофільними реагентами різко зменшується, внаслідок вищезгаданого p-π-спряження, тому аміди є дуже слабкими ацилюючими агентами.
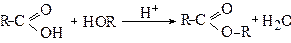
5. Утворення естерів (реакції естерифікації)
Реакцію естерифікації карбонових кислот спиртами розглядали раніше (див.стор.). Каталізаторами даної реакції є кислоти (Н+):
Механізм реакції естерифікації:
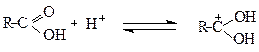
Карбокатіон
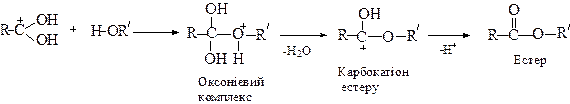
Окремі представники
Мурашина кислота одержується у промисловості таким методом:
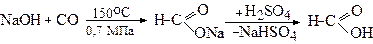
Мурашина кислота містить альдегідну групу і тому є сильним відновлювачем. Так, вона вступає у реакцію срібного дзеркала, перетворюючись на карбонатну кислоту (Н2СО3), яка розпадається на СО2 та Н2О:
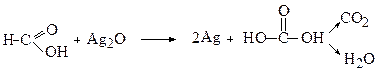
У присутності органічної кислоти вона при нагріванні розпадається:
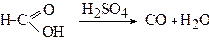
Оцтову кислотуодержують: 1) окисненням ацетальдегіду, одержаного за реакцією Кучерова з ацетилену; 2) каталітичним окисненням етилового спирту; 3) рідкофазним окисненням бутану. Реакція протікає за вільнорадикальним механізмом:
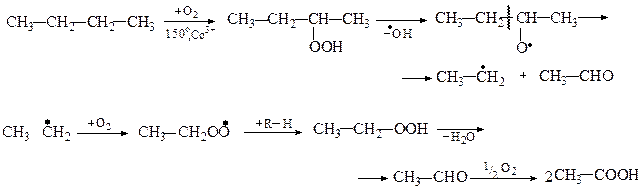 4) оксосинтезом з метилового спирту (карбонілюванням):
4) оксосинтезом з метилового спирту (карбонілюванням):
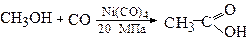
Оцтову кислоту застосовують для:
- одержання естерів, метилацетату, етилацетату тощо;
-одержання вінілацетату і далі поливінілацетатних смол, які широко використовуються у виробництві пластичних мас і лаків;
- одержання монохлороцтової кислоти, з якої виготовляють карбоксилметилцелюлозу, що, у свою чергу, є важливим замінником харчових матеріалів (крохмалю, борошна і деяких жирів), які застосовують для технічних цілей;
- одержання гербіцидів, наприклад, виробництво феноксиоцтової кислоти, які застосовують у сільському господарстві;
Оцтову кислоту застосовують в анілінбарвниковій, фармацевтичній і парфумерній промисловості. Так, у фармацевтиці, її використовують для виготовлення аспірину, антипірину, свинцевого оцту тощо. Оцтову кислоту широко застосовують при одержанні багатьох органічних і мінеральних барвників, синтетичного індиго.
Велику кількість оцтової кислоти використовують і в інших галузях народного господарства. Так, у текстильній промисловості для фарбування та друку тканин або у вигляді різних солей для їх протрави. У харчовій промисловості, переважно, для маринування, як консервуючий і смаковий засіб. Також оцтову кислоту використовують при одержанні казеїну, декстрину, при добуванні каучуку. Значну кількість оцтової кислоти споживають у побуті у вигляді оцту або оцтової есенції.
МОНОКАРБОНОВІ НЕНАСИЧЕНІ КИСЛОТИ
Загальна формула ненасичених кислот етиленового ряду
СnН2n-1СООН, й ацетиленового ряду – СnН2n-3СООН.
Для утворення назв можуть бути застосовані ті ж самі правила номенклатури IUPAC, що і для одноосновних насичених кислот. Однак, головний ланцюг вибирають так, щоб він обов’язково містив кратний зв’язок. Положення цього зв’язку у головному ланцюзі позначають локантом. Широко застосовуються також тривіальні назви (табл.2). Ізомерія ненасичених кислот визначаться будовою вуглеводневого скелету і положенням подвійного (потрійного) зв'язку. Для деяких кислот етиленового ряду має місце цис-, транс-ізомерія.
Таблиця 2
Дата добавления: 2016-02-11; просмотров: 9967;
