Назви дикарбонових кислот
| Формула | Замісникова номенклатура | Тривіальні назви | |
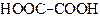
| Етандіова кислота | Щавлева (оксалатна) кислота | |
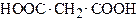
| Пропандіова кислота Метандикарбонова кислота | Малонова (малонатна) кислота | |
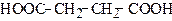
| Бутандіова кислота Етандикарбонова кислота | Бурштинова (сукцинатна) кислота | |
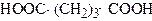
| Пентандіова кислота 1,3-Пропандикарбонова кислота | Глутарова кислота | |
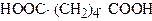
| Гександіова кислота 1,4-Пропандикарбонова кислота | Адипінова кислота | |
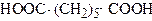
| Гептандіова кислота 1,5-Пропандикарбонова кислота | Пімелінова кислота | |

| Октандіова кислота 1,6-Пропандикарбонова кислота | Коркова кислота | |
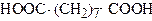
| Нонандіова кислота 1,7-Пропандикарбонова кислота | Азелаїнова кислота | |

| Декандіова 1,8-Октандикарбонова кислота | Себацинова кислота | |
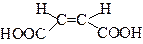
| цис-Бутендіова кислота | Малеїнова (малеїнатна) кислота | |
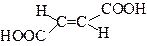
| транс-Бутендіова кислота | Фумарова (фумаратна) кислота | |
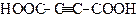
| Бутиндіова кислота | Ацетилендикарбонова кислота | |
СПОСОБИ ОДЕРЖАННЯ
Способи одержання дикарбонових кислот аналогічні одержанню насичених і ненасичених монокарбонових кислот.
1. Окиснення двопервинних гліколів
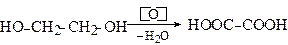
2. Гідроліз динітрилів
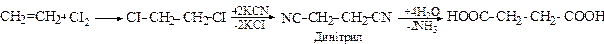
3. Дегідратація гідроксикислот
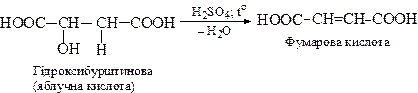
4. Реакція дегідрогалогенування
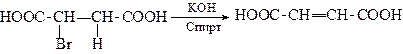
Бромосукцинатна
кислота
5. Окиснення алкенів, ароматичних вуглеводнів
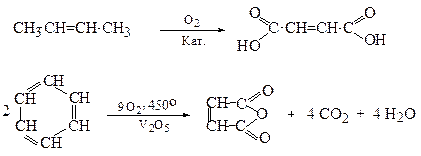
Малеїновий
Ангідрид
ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Насичені двоосновні кислоти
Дикарбонові кислоти - кристалічні речовини, розчинні у воді. Перші представники дикарбонових кислот сильніші кислоти, ніж монокарбонові. Це пояснюється взаємним впливом карбоксильних груп одна на одну, що полегшує дисоціацію
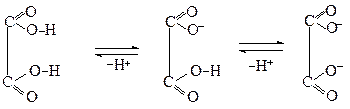
Однозарядний аніон Двозарядний аніон
(перший ступінь другий ступінь
дисоціації) дисоціації)
Константа дисоціації за першим ступенем набагато більша, ніж за другим, особливо для щавлевої і малонової кислот. Таким чином, найсильнішою кислотою є щавлева. Кислотність глутарової та адипінової кислот практично не відрізняється від кислотності оцтової кислоти, що пояснюється зменшенням взаємного індуктивного впливу карбоксильних груп одна на одну.
Дикарбонові кислоти здатні утворювати повні і неповні солі (середні та кислі), естери, аміди, галогенангідриди тощо. Разом з тим, наявність двох СООН-груп надає їм деяких особливостей.
1. Декарбоксилювання щавлевої та малонової кислот
При нагріванні вказаних кислот вище температури топлення відбувається декарбоксилювання (відщеплення СО2) однієї карбоксильної групи.
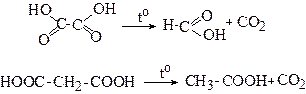
2. Утворення циклічних ангідридів
Бурштинова і глутарова кислоти при нагріванні здатні утворювати циклічні ангідриди.
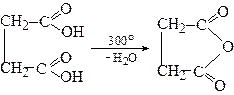
Бурштиновий ангідрид
(сукцинангідрид)
3. Піроліз кальцієвих або барієвих солей кислот, які містять п'ять або більше атомів вуглецю
У результаті піролізу утворюються циклічні кетони:
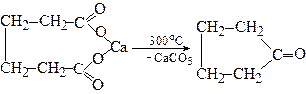
Циклопентанон
4. Синтези на основі малонової кислоти
Атоми водню метиленової групи малонової кислоти характеризуються високою кислотністю, завдяки значній поляризації зв'язків С-Н, внаслідок прояву -І-ефекту двох карбоксильних груп.

У синтезах застосовується не малонова кислота, а її діетиловий естер, що називається “малоновий естер”.
У присутності алкоголятів лужних металів малоновий естер обмінює один з протонізованих воднів метиленової групи на йон натрію з утворенням натріймалонового етеру або діетилмалонату натрію.
Натріймалоновий етер порівняно легко алкілюється, ацилюється тощо, чим зумовлене його широке застосування в органічному синтезі.

Малоновий Натріймалоновий
естер естер
Можливість утворення натріймалонового естеру пояснюється високою стабільністю його карбаніону, негативний заряд якого за рахунок спряження делокалізується між центральним атомом вуглецю (І) та двома карбонільними киснями (ІІ і ІІІ):
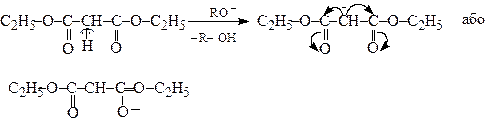

Дата добавления: 2016-02-11; просмотров: 3245;
