ХIМIЧНI ВЛАСТИВОСТI
Дегiдратацiя спиртiв
2.1. Метод С.В.Лєбєдєва на основі етилового спирту:
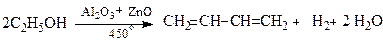
2.2. Дегідратація діолів. Дотепер у промисловості застосовують дегiдратацiю двоатомних спиртiв (діолiв). Наприклад, 1,4-бутандiол, який добувають реакцiєю конденсацiї ацетилену i формальдегiду за В.Реппе при нагріванні з водовідщеплюючими засобами утворює 1,3-бутадієн:

2.3. Метод О.І.Фаворського
Ізопрен добувають дегідратацією ненасиченого спирту 2-метил-3-бутен-2-олу (спирту О.І.Фаворського), який у свою чергу одержують конденсацією ацетилену з ацетоном у присутності твердого КОН :
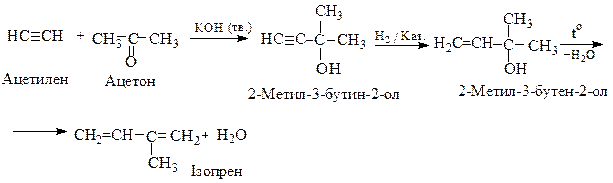 3. Конденсацiя алкенiв з альдегiдами (метод Прiнса)
3. Конденсацiя алкенiв з альдегiдами (метод Прiнса)
Ще один промисловий метод добування iзопрену базується на використанні iзобутилену i формальдегiду.
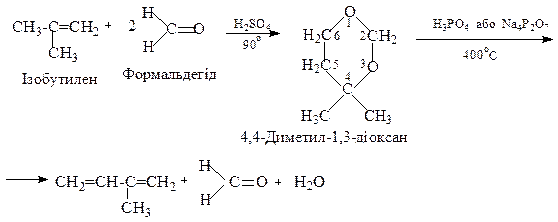
Добування хлоропрену
З ацетилену (Ю.Ньюленд)
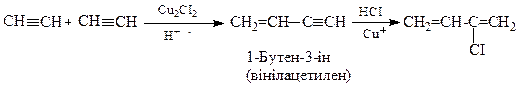
4.2. 3 1,3- бутадiєну
Це сучасніший і безпечніший метод в порiвняннi з виробництвом на основі вiнiлацетилену. 1,3-Бутадієн шляхом хлоруваня перетворюють у 3,4-дихлоро-1-бутен, який далi пiдлягає дегiдрохлоруванню:
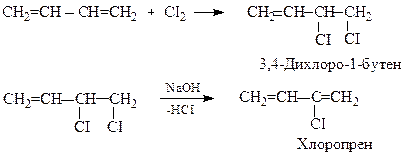
БУДОВА ДІЄНІВ
Будова алену.
У молекулi алену (пропадiєну) два π-зв’язки розташовуються у взаємно перпендикулярних площинах. Атоми водню також розміщені попарно у взаємноперпендикулярних площинах. Середній атом вуглецю перебуває в sp-, а крайні – в sp2- гібридних станах.
СН2=С=СН2
sp2 sp sp2
Будова 1,3-бутадiєну.
В молекулі 1,3-бутадiєну всі атоми вуглецю перебувають в sp2 гібридному стані. Молекула плоска (всі 10 атомів молекули лежать в одній площині). В цій же площині розташовані і σ-зв’язки молекули, які на рис.4.1 показані рисками.
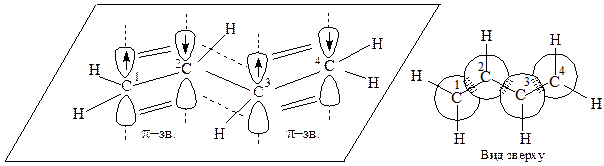
Рис. 4.1. Схема зв’язків в молекулі 1,3-бутадiєну
Вісі чотирьох негібридизованих 2р-орбіталей розташовані перпендикулярно до цієї площини і паралельні між собою. 2р-Орбіталі
С1 – С2 і С3 – С4 попарно перетинаються між собою, утворюючи два π-зв’язки (на рис. показані двома рисками). Разом з тим, перетинання р-орбіталей відбувається і в просторі між С2 і С3 . Отже має місце, π-π-спряження (на рис. показано пунктирними лініями), в результаті чого утворюється єдина спряжена π-електронна система молекули. Така система характеризується підвищеною термодинамічною стабільністю. Так, реальна ентальпія 1,3-бутадiєну на 13,6 кДж/моль менша, ніж розрахована. Цю різницю внутрішньої енергії називають енергією спряження або енергією резонансу. Перерозподіл електронної густини за рахунок π-π-спряження позначається так:
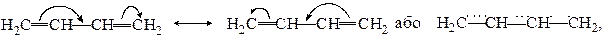
Iстинну будову молекули 1,3-бутадiєну треба розглядати з позицiї теорiї МО, де iснує поняття порядку зв’язку. Порядок зв’язку - це мiра його вiдхилення вiд одинарного. Наприклад, порядок вуглець-вуглецевого зв’язку в етанi (СН3-СН3) становить 1, в етиленi (СН2=СН2) - 2, в ацетиленi - 3. Порядок зв’язкiв мiж атомами С1-С2 i С3-С4 не 2, як слiд було очiкувати, а 1,89. У свою чергу, порядок зв’язку мiж С2 i С3 становить не 1, а 1,45.
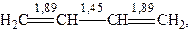
Причому порядок зв’язку 1,89 означає, що внесок σ-зв’язку становить 1, а частка π-зв’язку - 0,89. Вiдповiдно для С2-С3 частка π-зв’язку складає 0,45.
Отже в молекулі 1,3-бутадієну нема окремо подвійних і одинарних вуглець-вуглецевих зв‘язків, що і зумовлює деякі особливості поведінки 1,3-бутадієну. Зокрема приєднання до спряженої системи може відбутися як в положення 1,4-, так і в положення 1,2-.
1,3-Бутадiєн завдяки своїй будовi може iснувати у виглядi двох просторових конформерiв. Перехід з одного в другий здійснюється у результатi обертання навколо зв’язку С2-С3,, однак, цей перехід утруднений через наявність π-π-спряження. Тому обидва ізомери можуть бути легко розділені.
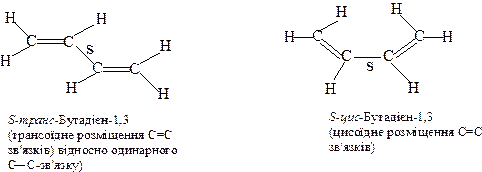
(cимвол “S”- від англ. single bond – одинарний зв’язок).
Причому, S-транс-форма стабiльнiша, нiж S-цис-форма приблизно на 10-12 кДж/моль i бiля 96% молекул 1,3-бутадiєну-1,3 перебуває в S-транс-формi.
ХIМIЧНI ВЛАСТИВОСТI
Ален
Ален в невеликих кількостях утворюється при пiролiзі алканiв. З метою утилізації його гiдрують до пропану, хоча потенцiйно ален можна використати для синтезу деяких цінних органічних продуктів.
Подвiйнi зв’язки в аленi мають високу реакцiйну здатнiсть у реакцiях приєднання (АE, АN або АR). Кiнцевими продуктами цих реакцiй є, як правило, сполуки з одним подвiйним зв’язком:
Наприклад, перспективним є синтез з алену ацетону та метилiзопропенiлового етеру:

Дiєновi вуглеводнi зi спряженими зв’язками
Особливостi будови 1,3-алкадiєнiв дозволяють їм вступати в реакцiї приєднання, аналогiчно алкенам. Але алкадiєни, в порiвняннi з алкенами, мають бiльшу реакцiйнуздатнiсть.
1. Реакцiї електрофiльного i радикального приєднання (АE i АR)
До алкадiєнiв приєднуються як галогени, так і галогенводнi за йонним або радикальним механiзмами.
1.1.Приєднання галогенiв
Приєднання галогенiв за йонним механізмом протiкає в положення 1,2 та 1,4. Вихiд 1,4-продукту зростає з пiдвищенням температури i при переходi вiд хлору до йоду. Цей продукт енергетично вигiдніший, нiж продукт 1,2-приєднання.
Механiзм приєднання галогенiв до дiєнiв аналогiчний механiзму приєднання до алкенiв. Утворюваний π-комплекс (комплекс з переносом заряду або сокрочено КПЗ) швидко перетворюється у спряжений (алiльний) карбокатiон, зображений двома граничними структурами (1) i (2), які приєднують аніон СІ-, перетворюючись на продукти реакції:
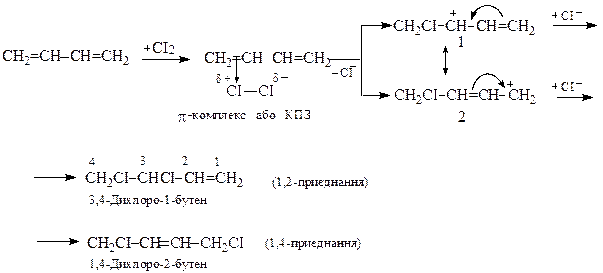
Приєднання галогенiв за радикальним механiзмом протiкає через стадiю утворення промiжного спряженого радикалу (алiльного типу) з подвiйною реакцiйною здатнiстю. Його будову так само можна подати двома граничними структурами (3) і (4). Цей радикал далі відриває атом від молекули хлору. Причому переважно утворюються продукти 1,4-приєднання:
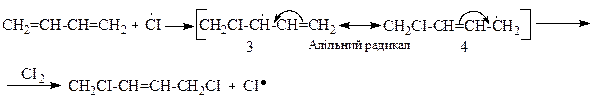
1.2. Приєднання галогеноводнiв
Електрофiльне приєднання починається з електрофiльної атаки протоном (Н+) спряженої π-електронної системи, у результатi чого утворюється нестiй-кий π-комплекс, що швидко переходить у спряжений карбокатiон алiльного типу (на схемi його зображено двома резонансними структурами). Приєднання СI до цього катiону дає два iзомерних хлоробутени:

2. Дiєновий синтез (реакцiя О.Дiльса-К.Альдера, 1928 р.)
Реакцiя дiєнового синтезу - це приєднання спряжених алкадiєнiв до алкенiв або алкiнiв з утворенням циклiчних сполук (реакцiї циклоприєднання):
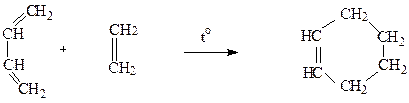
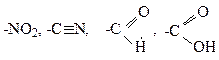 Реакцiї дiєнового синтезу легко протiкають, якщо алкени мiстять електроно-акцепторнi групи тощо).
Реакцiї дiєнового синтезу легко протiкають, якщо алкени мiстять електроно-акцепторнi групи тощо).
Такi алкени називаються дiєнофiлами:

Окремим випадком реакцiї дiєнового синтезу є реакцiї димеризацiї спряжених алкадiєнiв. Якщо обидвi молекули бутадiєну реагують за участю першого i четвертого вуглецевих атомiв, то утворюється 1,5-циклооктадiєн:
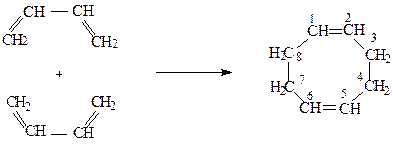
1,4-1,2-Приєднання веде до утворення вiнiлциклогексену-3:

3. Полiмеризацiя алкадiєнiв
1,3-Алкадiєни можуть легко полiмеризуватися за участю положень 1,4- або 1,2-. У реальних системах реакція вiдбувається одночасно за обома варіантами, але переважає 1,4-приєднання:
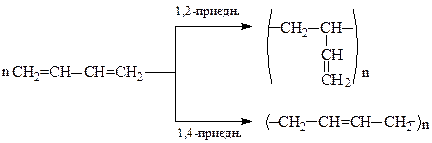
Продукти полiмеризацiї алкадiєнiв називаються синтетичними каучуками або скорочено - СК.
Каучуки і гуми
Каучуки дiляться на натуральний i синтетичнi.
Натуральний каучук - природний ненасичений полiмер iзопрену в цис-формi з молекулярною масою вiд 15 тис. до 500 тис., що добувається з соку тропiчних дерев родини Гевеї бразiльської. Ланки iзопрену приєднані одна до одної в 1,4-положеннях.
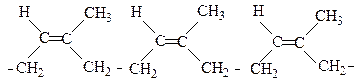
цис-1,4-Полiiзопрен
транс-Форма зустрічається в природі у виглядi гутаперчi.
Синтетичнi каучуки - аналоги натурального каучуку, що одержують синтетичним шляхом, переважно полімеризацією 1,3-алкадiєнiв.
Бутадiєновi каучуки (СКБ) - полімери 1,3-бутадiєну. Вiдомi бутадiєновi каучуки з 1,4-цис-, 1,4-транс- та 1,2-будовою. Це каучуки загального призначення.
Iзопреновий каучук (СКI) - одержують полiмеризацiєю iзопрену в присутностi каталiзаторiв Циглера-Натта, Al(C2H5)3 і TiCl4. За своїми властивостями цей каучук наближається до натурального.
Хлоропреновий каучук (“Наiрит” або “Неопрен”) - отримують полiмеризацiєю хлоропрену:
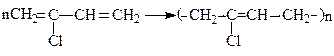
Характеризується високою хімічною стійкістю і може працювати в агресивних середовищах, а також в контакті з моторними паливами та оливами.
Бутадiєн-стирольнi каучуки - одержують спiльною полiмеризацiєю 1,3- бутадiєну i стиролу (стирену). Вони характеризуються високою стійкістю до стирання і використовуються для виготовлення атомобільних шин. Їх будова може бути представлена формулою:
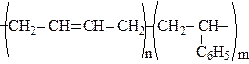
Вмiст зв’язаного стирену до 20%.
Бутадiєн-нiтрильний каучук (СКН) - одержують спiльною полiмеризацiєю 1,3- бутадiєну та акрилонiтрилу (до 40% зв’язаного акрилонiтрилу СН2=СН-CN)
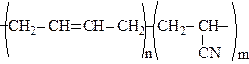
Каучуки характеризуються високою пластичністю, еластичністю але низькою пружністю та механічною міцністю. Для збільшення цих показників каучук перетворюють на гуму. Для цього до каучуку додають невелику кількість сірки і нагрівають до 130-150о. Цей процес називаються вулканізацією. Суть вулканiзацiї полягає в утвореннi нових поперечних (мiсткових) зв’язкiв мiж полiмерними макромолекулами. Сьогодні вулканiзацiю здiйснюють не тільки сiркою, але і органічними пероксидами та iншими сполуками.
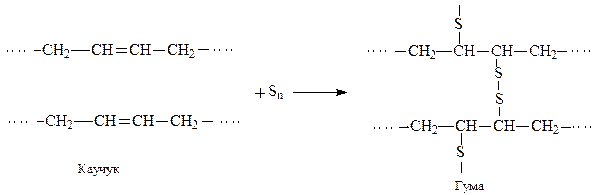
Гуми, на вiдмiну вiд каучукiв, не розчиняються в органiчних розчинниках, мають високу еластичнiсть i механiчну мiцнiсть.
| <== предыдущая лекция | | | следующая лекция ==> |
| Количественное определение | | | З карбонових кислот. |
Дата добавления: 2016-02-11; просмотров: 1933;
