Лекарственные препараты на основе ароматических кислот.
1. Бензойная кислота, Acidum benzoicum.
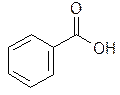 Бесцветные игольчатые кристаллы или мелкокристаллический порошок. Тпл=122-124,5°С. Мало растворим в воде, легко в спирте, хлороформе, маслах, в кипящей воде (1:25), возгоняется при нагревании.
Бесцветные игольчатые кристаллы или мелкокристаллический порошок. Тпл=122-124,5°С. Мало растворим в воде, легко в спирте, хлороформе, маслах, в кипящей воде (1:25), возгоняется при нагревании.
Содержится в некоторых смолах, бальзамах, в перуанском и толуанском бальзаме, клюкве, бруснике и других ягодах. В природе встречается иногда в связанном виде.
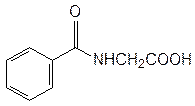
гинпуровая кислота
Получение.
1) Из толуола - окислением:
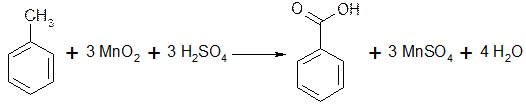
2) Из толуола – хлорированием с последующим омылением:
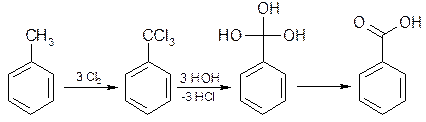
3) Из фталевой кислоты - декарбоксилированием:
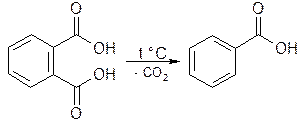
2. Кислота салициловая, Acidum salicylicum.
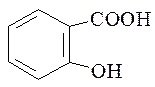
Орто-оксибензойная кислота.
Белые мелкие игольчатые кристаллы или кристаллический порошок без запаха. Тпл=158-161°С. Мало растворим в воде, растворим в кипящей воде, легко растворим в этаноле и эфире, трудно растворим в хлороформе.
Салициловая кислота широко распространена в природе, в листьях некоторых растений, в цветках ромашки. В виде метилового эфира салициловая кислота содержится во многих маслах, в том числе в масле гвоздики, туберозы, иве. В растениях метиловый эфир салициловой кислоты связан с сахарами в виде гликозидов, легко гидролизующихся под влиянием ферментов. Летуча с водяным паром, возгоняется. Относится к фенолокислотам.
Получение.
Карбоксилированием фенола по реакции Кольбе – Шмидта.
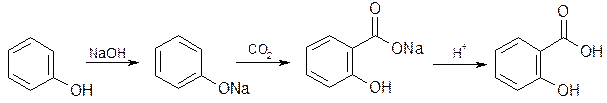
салицилат натрия
Выпаренную досуха смесь фенола и NaOH нагревают в автоклаве (130°С) с СО2 под давлением 450 –500кПа (4,5-5 атм). Продукт реакции растворяют в воде, подкисляют HCl и перекристаллизовывают. Побочный продукт реакции – оксидифенил.
3. Натрия бензоат. Natrii benzoas.
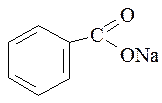
Белый кристаллический порошок без запаха или с очень слабым запахом, сладковато – соленого вкуса. Легко растворим в воде, трудно растворим в этаноле.
4. Натрия салицилат. Natrii salicylas.
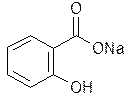
Белый кристаллический порошок или мелкие чешуйки без запаха, сладковато-соленого вкуса. Легко растворим в воде, растворим в этаноле.
Получение
Натрия бензоат и натрия салицилат получают, выпаривая досуха раствор соответствующей кислоты (бензойной или салициловой), нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:
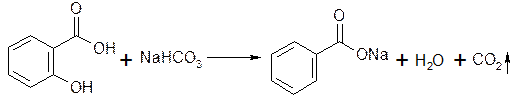
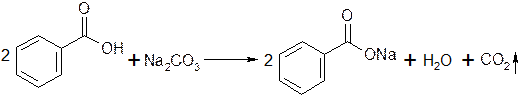
Соли перекристаллизовывают из спирта.
Реакции подлинности.
1. ГФ Х. Бензойную кислоту и ее соли определяют по реакции комплексообразования с FeCl3.
1.1. Кислоту нейтрализуют щелочью (по индикатору рН≈7). В кислой среде осадок растворяется, в щелочной среде выпадает бурый осадок гидроксида железа (III).

1.2. С хлоридом железа (III) образуется комплексная соль:
6 C6H5COONa + 2FeCl3 + 10H2O →
→ (C6H5COO)3Fe·Fe(OH)3·7H2O↓ + 3 C6H5COOH + 6 NaCl
желтовато-розовый цвет
2. Реакция образования салицилатного комплекса.
2.1. Для бензойной кислоты и бензоата натрия.
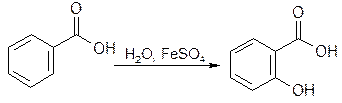
2.2. Салициловую кислоту доказывают по фиолетовому окрашиванию комплекса с хлоридом железа (III).
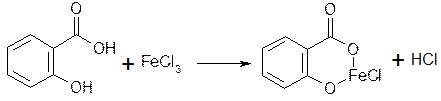
моносалицилат железа
фиолетовый цвет рН=2-3
Для салициловой кислоты и ее соли:
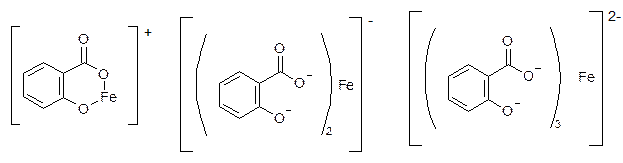
Моносалицилат дисалицилат трисалицилат
рН=2-3 рН=3-8 рН=8-10
фиолетовый красный желтый
При добавлении минеральных кислот указанные комплексы разрушаются, окраска исчезает и выпадает белый осадок салициловой кислоты. В присутствии СН3СООН окраска сохраняется.
Соли кислот вступают в реакцию с другими солями тяжелых металлов.
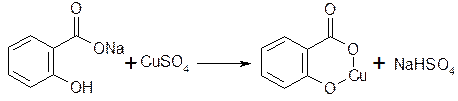
зеленый цвет
3. Реакция декарбоксилирования.
3.1. При нагревании выделяется фенол, который определяют по запаху:
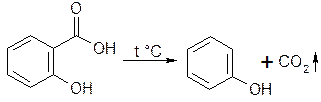
запах фенола
3.2. С концентрированной серной кислотой
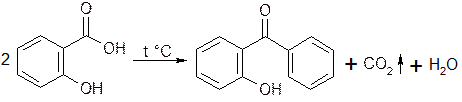
СО2+ Са(ОН)2 → СаСО3↓+Н2О
помутнение
4. Реакция конденсации с реактивом Марки.

5. Реакция этерификации с этанолом.

C6H5COOН + C2H5OH C6H5COOC2H5 + Н2О
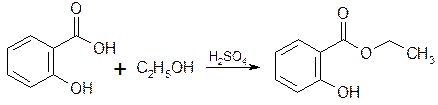
Тпл=122-124,5˚С для бензойной кислоты, Тпл=158-161˚С для салициловой кислоты.
Дата добавления: 2016-03-27; просмотров: 1707;
