Влияние температуры на скорость реакций в биологических системах.
Энергия активации.
Большинство реакций, специфичных для биологических систем – ферментативно каталихируемые. Рассмотрим энергетический профиль обычной реакции, проходящей в растворе по механизму столкновений А+В=Р
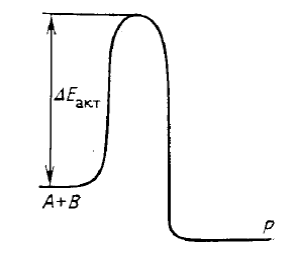
Образование продукта Р происходит,если энергия сталкивающихся молекул исходных веществ А и В превышает величину энергетического барьера. Если уменьшить величину Еакт то реакция пойдет быстрее. Именно это и делает фермент(как и любой катализатор)
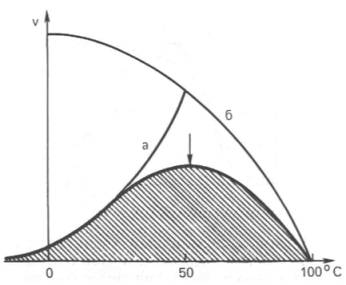
Зависимость скорости катализируемой ферментом реакции от температуры
Термолабильность ферментов. Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Установлено, что скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Так, при температуре, не превышающей 45–50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса.
Таким образом, термолабильность, или чувствительность к повышению температуры, является одним из характерных свойств ферментов, резко отличающих их от неорганических катализаторов. В присутствии последних скорость реакции возрастает экспоненциально при повышении температуры. При температуре 100°С почти все ферменты утрачивают свою активность (исключение составляет, очевидно, только один фермент мышечной ткани – миокиназа, которая выдерживает нагревание до 100°С). Оптимальной для действия большинства ферментов теплокровных животных является температура 40°С; в этих условиях скорость реакции оказывается максимальной вследствие увеличения кинетической энергии реагирующих молекул. При низких температурах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля. Во всех случаях имеет значение время воздействия соответствующей температуры. В настоящее время для пепсина, трипсина и ряда других ферментов доказано существование прямой зависимости между скоростью инактивации фермента и степенью денатурации белка. Следует отметить, что на термолабильность ферментов определенное влияние оказывает концентрация субстрата, рН среды и другие факторы.
| <== предыдущая лекция | | | следующая лекция ==> |
| Изменение энтропии в открытых системах. Постулат Пригожина. Термодинамические условия осуществления стационарного состояния. Примеры | | | Люминесценция и ее применение для изучения динамики белков. |
Дата добавления: 2016-04-11; просмотров: 2856;
