Люминесценция и ее применение для изучения динамики белков.
Люминесцентные методы позволяют измерять внутримолекулярную подвижность белка, изучая, как зависит от температуры положение максимума люминесценции введенной в белок метки максимума либо собственной люминесценции триптофана белка.
Здесь можно о схеме Яблонского.
Когда переход в возбужденное состояние значительно изменяет электрический дипольный момент молекулы по сравнению с дипольным моментом в состоянии S0, поле диполей окружающей среды также оказывается неравновесным. Диполи среды за время жизни молекулы-хромофора в возбужденном состоянии могут успеть переориентироваться в соответствии с новым полем диполя возбужденного хромофора. Релаксация диполей лимитируется динамическими свойствами среды. Если время дипольной релаксации среды тр много больше времени жизни возбуждения хромофора т(тау)*, то релаксация за время т* не успевает произойти, т. е. окружение хромофора жесткое. При тр < т* быстрая дипольная релаксация успевает произойти за время т* существования возбуждения в молекуле хромофора. Это снижает энергетический уровень возбужденного электрона, вызывая сдвиг максимума спектра флуоресценции в длинноволновую сторону.
В сложной системе (белок), где изменение электронного состояния молекулы-хромофора вызывает реорганизацию его микроокружения, время релаксации среды может быть больше времени жизни электронного возбуждения (тр > т*). Этого не наблюдается в отдельных молекулах-хромофорах, где внутримолекулярная колебательная релаксация занимает 10-12- 10-11 с.
Изменяя релаксационные свойства среды (при изменении температуры), можно влиять на соотношение между тр и т*. Это находит свое отражение в положении максимума лямбдашах спектра флуоресценции. Таким методом можно получить ценную информацию о подвижности белков, изучая собственную флуоресценцию триптофана. Индол триптофана характеризуется большим изменением момента перехода при возбуждении (до 4D). Поэтому положение максимума его спектра флуоресценции сильно зависит от подвижности диполей среды и может варьировать до 30 нм. Так как т* для 5*-состояния триптофана составляет единицы наносекунд, то по этим данным можно судить о структурных перестройках в белке в наносекундном временном диапазоне. Белки обладают характерными двухступенчатыми кривыми зависимости положения спектра флуоресценции от температуры в области от —90 до 0°С. Сдвиги полосы флуоресценции на 4 - 9 нм в области от —90 до —20°С и на 5- 12 нм в области от —20 до 0° свидетельствуют о замораживании движений в белковой матрице в наносекундном диапазоне. Высушенные белки не дают этих спектральных сдвигов, что подчеркивает роль воды как необходимого фактора для появления подвижности белка. Система белок - вода замерзает как единая микрофаза. Если вводить в белок экзогенные фосфоресцирующие метки (например, производные эозина), то таким способом можно оценивать более длинные характерные времена структурных перестроек (до 1 с). В глубоких слоях белковых макромолекул происходят медленные движения тp ~ 1 с, а в более поверхностных слоях эти движения существенно быстрее: тp ~ 10- с. Найденные времена характеризуют подвижность только ближайшего микроокружения люминесцирующего хромофора и не могут распространяться на всю макромолекулу. Число и места локализации таких люминесцирующих меток в белке зависят их от химических особенностей и от характера взаимодействия с белковыми группами.
Методы радиоспектроскопии включают главным образом метод электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР).
Можно рассказать о ЭПР)
Если вязкость в образце мала, то за счет быстрых молекулярных движений взаимные влияния спинов успевают усредниться при поглощении переменного поля. В этом случае резонанс наблюдается при усредненной линии с уменьшенной шириной. Наоборот, замораживание раствора и уменьшение его вязкости вновь замедлят молекулярные движения. Тогда при поглощении энергии переменного поля спины успевают почувствовать влияние разных локальных полей в своем микроокружении, что уменьшит время сохранения спинового состояния и вызовет уширение общей линии резонанса. Т. о. измеряя ширину линии поглощения, можно получить данные о характере внутримолекулярных движений в микроокружении спиновой частицы (радикал, протон). В методе спиновых меток к функциональной группе белка присоединяют свободный радикал, дающий сигнал ЭПР. Характеристики сигнала ЭПР являются показателем подвижности микроокружения этого радикала. Наиболее удобны нитроксильные метки, содержащие свободнорадикальную группу N – О., где неспаренный электрон фактически делокализован между атомами N и О. Сигнал ЭПР этой метки имеет определенную структуру, которая обусловлена влиянием магнитного момента ядра азота на неспаренный электрон наряду с действием на него внешнего магнитного поля. Вращение нитроксильного радикала относительно направления внешнего поля изменяет структуру сигнала ЭПР. Существуют методы расчета, которые позволяют по параметрам сигнала ЭПР оценить характерное время тс вращения метки. Время вращения метки зависит от глубины ее погружения в слоях белковой глобулы. В наружном водном слое значения тс составляют 10-11 - 10-10 с. Поверхностные слои характеризуются значениями ~ 10-10 - 10-8 с, в глубоких слоях плотного гидрофобного ядра глобулы ~ 108 - 10-7 с. Было обнаружено также резкое увеличение ферментативной активности высушенных препаратов реакционных центров фотосинтеза при их увлажнении, которое коррелирует с одновременным падением значений тс спин-метки. Это говорит об изменении динамического состояния и одновременном появлении внутримолекулярной подвижности и функциональной активности белка.
Развитие этого метода позволило изучать динамику мембранных белков, белок- белковые и белок-липидные взаимодействия в биологических мембранах.
Так с помощью спектроскопии с переносом насыщения была исследована динамика Са-АТФазы в мембранах саркоплазматического ретикулума и протеолипосомах, что позволило выявить связь конформационной подвижности белка с его АТФазной активностью, показать, что внутримолекулярная подвижность и активность Са-АТФазы зависят от природы ассоциированных с этим белком липидов. Исследования, проведенные на фоторецепторных мембранах, позволили обнаружить как необратимую агрегацию родопсина, возникающую при повреждении светом этих мембран, так и обратимую ассоциацию родопсина, связанную, по всей видимости, с функцией этого белка
Метод ЯМР. Изучение динамики белковых структур методом ЯМР основано на измерении времени релаксации Т1 и Т2 по ширине линии резонанса. Удается найти значения тс для ядер, на которых наблюдается резонанс.
Изучая протонный резонанс, можно оценить подвижность белковых групп, в состав которых входят "резонирующие" протоны. Метод ЯМР позволяет изучать определенные виды внутримолекулярного движения в белках. Так, температурные измерения времени Т1 в сывороточном альбумине обнаруживают вращения метильных групп с временами ~ 10-10 с при - 100° наблюдаются более медленные движения ~ 10-8 с (возможно, осцилляции полипептидной цепи). По времени Т2 для протонного резонанса удается определить три характерных диапазона времен тс: медленное вращение глобулы как целого (тс ~ 10-5 с), внутренние движения (тс ~ 10-5 - 10-6 с), движение внешних наиболее подвижных групп белка (тс ~ 10-10 с). Метод ЯМР дает важную информацию и о химической структуре молекулы. Она проявляется в результате разного влияния локальных полей соседних ядер на положение полосы резонанса отдельных протонов, занимающих различные места в структуре молекулы. Вследствие этого у разных протонов резонанс появляется на разных частотах. Это явление называется химическим сдвигом. Кроме того, структура полосы ЯМР так же, как и в случае ЭПР, отражает тонкие эффекты влияния магнитных моментов ядер, передающиеся через электронные связи в молекуле. Сейчас широко используются данные по резонансу на 31Р, а также на 13С, линии которого находятся в стороне от основной массы перекрывающихся линий. Анализ спектровЯМРдля отдельных сравнительно небольших белков с выделением линий от метильных, метиленовых, SH-групп, остатков триптофана, тирозина, гистидина.
Заметно большее разрешение достигается в спектрах ЯМР для 13С, имеющего более широкий диапазон химических сдвигов по сравнению с протонами. Здесь выделяют также отдельные линии карбонильных групп, остатков аланина, аргинина и ряда других. На основе использования двумерной ЯМР спектроскопии удается разделить эффекты, связанные с химическим сдвигом и с косвенным спин-спиновым взаимодействием. Ряд структурно-динамических характеристик может быть получен на основе изучения процессов спиновой диффузии, связанной с тем, что переходы спинов при резонансе индуцируют такие же переходы для соседних спинов в случае частичного или полного перекрывания их резонансных линий. Все это сделало метод ЯМР одним из ведущих методов изучения структуры и динамики биополимеров непосредственно в растворе.
Метод ядерной гамма-резонансной (ЯГР) спектроскопии дает важную информацию о динамике белков. В отличие от методов ЭПР и ЯМР он дает не только временные, но и амплитудные характеристики движений в белке. Метод позволяет определять средние величины смещений атомов в структуре белка, которые происходят в течение коротких времен 10-7 - 10-9 с. Метод основан на резонансном поглощении у - квантов тяжелым ядром атома, например ядром изотопа Fe, который содержится в природных соединениях в количестве 2,2%. Энергия у-кванта, поглощенного ядром изотопа Fe, составляет ∆Е = 0,0144 мЭв, а время жизни ядра 57Fe в возбужденном состоянии т* ~ 10-7 с. В реальных условиях резонансная частота поглощения у-квантов ядром не совпадает с частотой самого у-кванта. При поглощении у-кванта ядром Fe часть энергии кванта превращается в кинетическую энергию отдачи, т. е. в поступательную энергию движения самого ядра. Это значит, что на самом деле энергия у-кванта, используемая для непосредственного возбуждения ядра 57Fe, будет уменьшена на величину, равную энергии отдачи. В результате резонансная частота поглощения сместится по сравнению с исходной частотой самого у-кванта. Поскольку естественная ширина линии очень мала (Г ~ 10-8 эВ), а энергия отдачи для свободного 57Fe намного больше 2-10-3 эВ, то этот сдвиг будет очень заметен. Реальная величина энергии отдачи зависит от способности ядра атома 57Fe воспринять импульс отдачи, а это в свою очередь определяется его собственной подвижностью. В твердых телах возможно поглощение у-квантов без отдачи, когда энергию отдачи берет на себя весь кристалл в целом, а смещений ядра 57Fe вообще не происходит. Этот эффект поглощения у-квантов без отдачи называется эффектом Мессбауэра. В этом случае в спектрах поглощения у-квантов появляются линии, не смещенные по энергии из-за отсутствия отдачи. С ростом среднеквадратичного смещения х(с чертой)2, мессбауэровского ядра 57Fe вероятность f' поглощения без отдачи у-кванта падает. Наоборот, при малых х(с чертой)2 не происходит передачи энергии ядру, жестко связанному с окружением, и вероятность f' приближается к единице.
Зависимость вероятности поглощения без отдачи от х(с чертой)2 носит экспоненциальный характер:
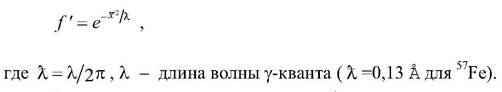 .
.
Измеряя вероятность поглощения без отдачи в различных условиях температуры и влажности, можно оценить величину смещения ядра мессбауэровского атома, т. е. получить амплитудную характеристику его подвижности. Нормальный белок обладает характерной температурной зависимостью f ' (Т) с изломом, что говорит о кооперативном характере размораживания внутренней подвижности при температурах излома. Сухой белок такими свойствами не обладает, а скорее напоминает обычное твердое тело, где увеличение х(с чертой)2 с температурой носит монотонный характер. При температурах 77 - 200 К мессбауэровские ядра колеблются с малыми амплитудами (0,1 А), а при высоких температурах появляются более крупномасштабные смещения (0,3 - 0,6 А). Увеличение внутренней подвижности белка и в этом случае коррелирует с соответствующим ростом его функциональной активности. Временное разрешение в методе ЯГР лимитируется временем т* возбужденного состояния ядра 57Fe (т* ~ 10-7 с). С помощью метода ЯГР измеряется смещение мессбауэровского ядра, которое атом успевает пройти за время 10 -7 с.
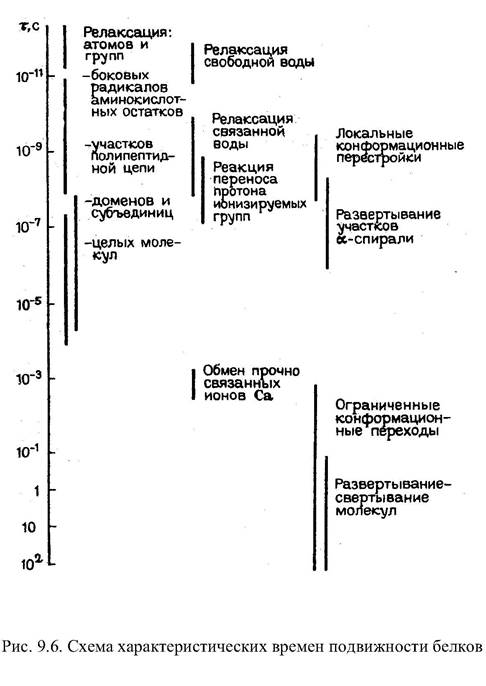
Картинка 3 «Общая классификация подвижности элементов структуры белка по характерным временам отдельных видов движений»
+ картинки «внутримолекулярная подвижность белков» и «движение молекул, времена».


| <== предыдущая лекция | | | следующая лекция ==> |
| Влияние температуры на скорость реакций в биологических системах. | | |
Дата добавления: 2016-04-11; просмотров: 1933;
