Специфика биологического познания.
Описание. До XX в. биология во многом нематематична и описательна. Но уже в XIX в. наметилась четкая тенденция теоретического синтеза . На это повлияли социокультурные факторы (расширение международных контактов, технический прогресс и т.п.). Эволюционную теорию Ч. Дарвина и теорию эволюции мозга американского натуралиста Д. Дана (1813-1895) объединяет то, что оба ученых собирали факты во время многолетних кругосветных плаваний. Дарвин плавал с экспедицией на корабле «Бигль» с 1831 по 1836 г., Дан — на корабле «Пикок» с 1838 по 1842 г. Оба ученых смогли оценить жизнь природы в планетном аспекте.
Открытие клетки. Глобальность биологического подхода проявилась не только в большом, но и в малом. С введением в XVII в. микроскопа ученые приступили к изучению глубин жизни. Р. Гук и Левенгук установили, что растения имеют клеточное строение. В 1839 г. немецкие ученые М. Шлейден и Т. Шванн открыли, что все живое состоит из клеток. Английский ботаник Р. Броун обнаружил в 1831 г. ядро растительной клетки. В 1837 г. чешский естествоиспытатель Я. Пуркине выявил, что все растительные и животные клетки имеют ядра. Клеточная теория заменила старую доктрину о том, что структура организма сводится к основным жидкостям («гуморы»).
Утверждение эксперимента. Сразвитием биологии в ней рос объем экспериментальных исследований. В главной книге Дарвина содержится 100 таблиц с изменениями растений, подвергнутых перекрестному опылению и самоопылению, а также описаны опыты по скрещиванию голубей. С 1856 г. чешский монах Г. Мендель начал опыты по скрещиванию видов гороха. В 80-е годы возникают экспериментальная морфология растений и экспериментальная эмбриология животных (Ру, Дриш). В конце XIX в. Ф. Гальтон предложил методику биометрии для экспериментального изучения естественного отбора.
От алхимии к химии.В XVII в. на химии еще были обрывки одежды алхимии. Но мировоззренческие и доктринальные идеи радикально пересматривались. Химические вещества уже не трактовались как проявления живого, они стали косной и неживой материей. На место «свадьбы» металлов пришла химическая реакция исходных продуктов. Алхимик оперировал идеей «первоэлемента», по которой химическое качество представлялось как абсолютно изолированное, пребывающее в теле как в неком вместилище. Английский ученый Р. Бойль (1627-1691) в книге «Химик-скептик» развенчал этот предрассудок и показал, что тела определяют свои качества в отношениях друг к другу. И в этом плане все химические качества соотносительны.
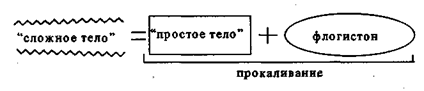
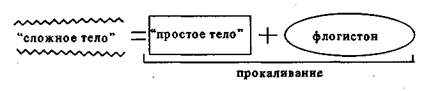
Определение химического элемента. Химики XVII в. поставили важную проблему: «Как выделить «простое тело» из сложной смеси тел?» Под «простым телом» понимался предел опытного химического разложения. Это был прообраз современного химического элемента. В качестве способа разложения «сложных тел» было предложено прокаливание. Оно вытекало из концепции флогистона. «Сложное тело» состоит из «простого тела» и флогистона. При прокаливании металлов как сложных тел флогистон улетучивается и остаток (окислы) выступает «простым телом». Здесь ошибочная теория привела к превратной процедуре, ибо прокаливание простое (металл) делает сложным (оксид). Когда Лавуазье установил роль кислорода в процессе горения и указал на ошибочность идеи флогистона, прокаливание как процедура установления химических элементов была отброшена.
Но и при ошибочной теории научная практика давала свои плоды. Были открыты многие подлинные элементы химии: фосфор (1669), кобальт (1736), никель (1751), водород (1766), фтор (1771), азот (1772), хлор и марганец (1774), кислород (1772-1776). Также была отработана методика взвешивания химических продуктов. Она вывела Лавуазье и Ломоносова к очень важному теоретическому выводу. Проведя серию опытов с обжигом металлов в герметических ретортах, французский ученый в 1789г. сформулировал и опубликовал закон сохранения вещества в химических реакциях. Этот закон Лавуазье оценивал как одно из выражений принципа сохранения материи. (Ломоносов не публиковал свои результаты).
Химический атомизм.В 1800-1809 гг. французский химик Ж. Пруст установил «закон постоянства состава», согласно которому любое индивидуальное химическое соединение обладает строго определенным и неизменным составом. Этот эмпирический закон объяснил английский ученый Дж. Дальтон (1766-1844), который первым ввел в химию атомизм. По его представлению, каждому химическому элементу соответствуют специфические атомы как маленькие шарики, между которыми действуют силы притяжения и отталкивания. Силы отталкивания присущи частицам теплорода, обволакивающим атомы. Так как атомы различных веществ отличаются друг от друга величиной и весом, то нужно определить относительный вес атомов и их относительные размеры. Дальтон составил таблицу атомных весов химических элементов (атомный вес водорода был принят за единицу) и дал первые формулы химических соединений, введя символы для атомов химических элементов. Эта таблица была далека от совершенства. Приняв для воды неправильную формулу (НО), Дальтон неправильно определил атомный вес кислорода, углерода и других элементов. Но в целом его атомистическое направление было правильным и перспективным.
Химический атомизм утверждался в ходе решения сложных проблем. Одна из них возникла в связи с открытием Гей-Люссаком в 1808 г. нового закона. Было установлено, что газы соединяются всегда в кратных объемных отношениях. Так, один объем водорода соединяется с одним объемом хлора и получается два объема хлороводорода. Согласно атомизму Дальтона, одинаковые объемы хлора и водорода содержат одинаковое число атомов и при реакции должны давать один объем хлороводорода. Объяснение дал итальянский химик А. Авогадро (1776-1856). В 1811 г. он выдвинул гипотезу о различении двух типов частиц: атомы и молекулы как комплексы атомов (о «корпускулах», состоящих из нескольких атомов, писал Ломоносов). Закон Гей-Люссака получил следующую трактовку. В равных объемах газов содержится одинаковое число не атомов, а молекул. Молекулы простых газов состоят из двух и более атомов.
Рождениепериодической системы элементов.В конце XVIII в. Лавуазье создал первую научную химическую систему. Наряду с подлинными элементами в нее вошли и сложные соединения (глинозем, кремнезем, магнезия, известь). Дело в том, что Лавуазье сохранил ошибочную идею Бойля – химический элемент есть то, что не поддается экспериментальному разложению. Данный предрассудок преодолел Дальтон и начал составлять таблицы на атомистической основе. Молекулярная гипотеза Авогадро развила эту линию.
Революция в химии. Важной победой атомно-молекулярного метода стало открытие русского химика Д. И. Менделеева (1834- 1907). В творческих муках, в которых не последнюю роль играли учебно-педагогические факторы, он пришел к новому принципу – химический элемент занимает свое место в периодической системе, определяемое его атомным весом (или атомной массой). Здесь тоже важен опыт, но измерение атомного веса имеет прямое отношение к сущности химического элемента.
Принцип систематизации элементов по их атомным весам проявил высокую познавательную силу. Многие химические элементы были предсказаны и уже потом установлены опытным путем. В конечном счете, в свою систему Менделеев включил 62 химических элемента. В XX и XXI вв. путем физического синтеза атомных ядер было открыто более 110 элементов. Элементы от 102-го и далее (нобелий – ... – мейтнерий) неустойчивы: период их полураспада составляет тысячные доли секунды. Сколько же всего в природе существует химических элементов? Один из теоретических ожидаемых пределов системы химических элементов – 118. Но есть прогнозы и на большее число.
Для своего времени открытие Менделеева было, безусловно, великим. Но его основу составил эмпирический закон, который в дальнейшем был объяснен и уточнен квантовой теорией атома. Оказалось, что место элемента в периодической системе обусловлено не его атомной массой, а зарядом атомного ядра. Так, изотопы хлора отличаются друг от друга по атомной массе, но оба относятся к одному химическому элементу – хлору. Химический элемент есть совокупность всех атомов, которые обладают одним зарядом ядра. Химические связи представляют собой проявление волновых свойств валентных электронов, дающих обменное взаимодействие электронных оболочек. Соответственно расширился взгляд на молекулы, в их число вошли атомные, ионные, металлические монокристаллы и полимеры, образованные водородными связями. Итак, современная химия неотделима от квантовой физики.
Дата добавления: 2016-04-02; просмотров: 1432;
