Особливості одержання та застосування ферментів целюлолітичного комплексу у біоконверсії целюлозовмісної сировини в енергоносії
Використання целюлозолітичних ферментів або мікроорганізмів, здатних споживати целюлозовмісну сировину, отримуючи із неї енергію, дає можливість здійснювати біоконверсію целюлозовмісної сировини.
Гідроліз лігноцелюлозної біомаси включає в себе деградацію довгого ланцюга полісахаридів, головним чином целюлози і геміцелюлоз до олігосахаридів з подальшим їх гідролізом до глюкози, целобіози і ксилози. Дані продукти представляють великий інтерес як сировина для подальшої переробки її в біоетанол та інші продукти біотехнології.
9.2.1. Біотехнологічні особливості одержання целюлаз. Для одержання целюлолітичних ферментів використовують як поверхневий (твердофазний), так і глибинний способи культивування, кожен з яких має свої переваги та недоліки.
Твердофазне культивування продуцентів целюлолітичних ферментів має такі переваги перед глибинним:
- активність ферментів при поверхневому культивуванні, як правило, на порядок вища, ніж при глибинному методі культивування одного й того ж штаму мікроорганізмів за рахунок відсутності розведення поживного середовища;
- більш висока продуктивність процесу виробництва на одиницю об’єму ферментера;
- менш складне технологічне обладнання для проведення процесу ферментації;
- в процесі культивування існує менший ризик зриву процесу внаслідок мікробної контамінації;
- легше здійснювати аерацію;
- менший об’єм використання води для технологічних потреб та менші об’єми стічних вод після виробництва;
- організація процесу виробництва целюлолітичних ферментів вимагає менших капіталовкладень.
Недоліками даного способу є:
- недосконалість конструкції обладнання, що використовується: на даний час не винайдено простого та практичного ферментера для здійснення твердофазного культивування;
- недостатня механізація та автоматизація технологічних процесів;
- час культивування є більшим у зв’язку із необхідністю проростання спор та обмеженням масопередачі розповсюдженням колонії.
Глибинне культивування продуцентів у періодичному режимі на рідкому середовищі – найбільш розповсюджений спосіб отримання гідролітичних ферментів. При такому способі клітини продуцента знаходяться у зваженому стані у поживному середовищі.
При глибинному культивуванні гриби-продуценти потрапляють у незвичні для себе умови (розбавлене рідке середовище, висока швидкість перемішування), у яких не кожен із них зберігає високу здатність до синтезу ферментів. Проте ферменти виділяються безпосередньо у розчин і по закінченню культивування фільтрат культуральної рідини може бути використаний як зручне джерело екзоферментів. Значно легшим є контроль параметрів процесу культивування: рН, концентрація субстрату, біомаси, кисню.
Досить суттєвим недоліком використання глибинного культивування у виробництві целюлолітичних ферментних препаратів є нерозчинність целюлози у воді. Оскільки використовуючи целюлозовмісну сировину в якості субстрату в промислових умовах культивування продуцента целюлаз буде гетерофазним, то це призводить до більш значних затрат енергії при роботі ферментера, більшого навантаження на фільтрувальні апарати під час відділення біомаси та твердих залишків субстрату від культуральної рідини.
Отже, твердофазна ферментація є економічно доцільною для виробництва целюлолітичних ферментних препаратів із низьким ступенем очищення (Пх, П2х, П3х), а глибинне культивування застосовують в процесі виробництва препаратів целюлаз, які мають більш високі ступені очищення (Г10х, Г20х).
Післяферментаційні стадії. Після завершення ферментації проводять відділення біомаси мікроорганізмів-продуцентів від культуральної рідини (за допомогою фільтрації або сепарування).
Відокремлену біомасу, що містить білки, цінні для біосинтезу амінокислот і ростові фактори, доцільно повертати як компонент поживного середовища або для глибинного культивування різних продуцентів ферментів, або для твердофазного культивування мікроскопічних грибів – продуцентів ферментів. Така операція дозволяє замінити в складі поживного середовища дефіцитні компоненти, наприклад, кукурудзяний екстракт або дріжджі, значно поліпшити склад повітряного басейну, знизити навантаження на очисні спорудження.
Культуральну рідину (після глибинного методу) або екстракт (після поверхневого культивування) концентрують у вакуум-випарних установках (при цьому може відбуватися інактивація ферментів). Концентрування розчинів ферментів здійснюють також за допомогою ультрафільтрації (на порожніх волокнах або на мембранних фільтрах), що істотно зменшує втрати порівняно з випарними методами. З водних розчинів ферменти осаджуються за допомогою органічних розчинників або солей. Сухі ферментні препарати одержують у результаті розпилювального висушування (що також супроводжується інактивацією).
Ферментні препарати, що випускаються промисловістю, крім активного білка містять ще різні баластові домішки, а крім основного ферменту – також комплекс інших ферментів. Найменування ферментного препарату складається зі скороченої назви основного ферменту й видової назви продуцента.
Наприклад, препарат, у якому основними ферментами є целлюлази, отриманий при культивуванні T.vіrіde називається целовіридином. Далі після маркування культури продуцента іде індексація, яка відображає спосіб культивування й методи одержання ферментного препарату.
Культури мікроорганізмів, вирощені поверхневим або глибинним способами, відповідно позначаються індексами "Пх", "Гх". Препарати у вигляді концентрованих сиропів позначаються індексами "П2х" і "Г2х", а отримані шляхом концентрування культуральной рідини у вакуум-випарних установках з наступним сушінням концентратів на розпилювальних сушарках – "ГЗх".
Препарати, одержані осадженням органічними розчинниками з дифузійної витяжки або концентрату культуральної рідини, одержаного при вакуум-випарюванні, позначаються індексами "П10х", "Г10х", а виготовлені осадженням сірчанокислим амонієм з тих же напівпродуктів - "П15х", "Г15х", відповідно.
Препарати одержані шляхом концентрування й очищення дифузійних екстрактів або культуральних рідин на ультрафільтраційних установках з наступним сушінням, залежно від ступеня очищення – індексами "П20х", "П30х", "Г20х" "Г30х" і т.д.
Асортимент та коротка характеристика стадій післяферментаційного виділення мікробних целюлаз наведена у табл. 9.1 – 9.3.
Треба зазначити, що ферментативний гідроліз целюлози здійснюється комплексом ферментів, які різняться між собою за субстратною специфічністю. Ендоглюканаза здатна невпорядковано гідролізувати глікозидні β-1,4 зв’язки у целюлозі, ліхеніні та β-глюканах, що віддалені від кінців полімерного ланцюга з утворенням фрагментів полімерного ланцюга та целоолігосахаридів. Це фермент, який першим атакує молекулу целюлози.
Таблиця 9.1
Очистка і характеристика ендоглюканаз із мікробних джерел [11]
| Мікроорганізм - продуцент | Методи виділення і очистки | Характеристика |
| Sporotrichum рulverulentum | Осадження сульфатом амонію, іонообмінна хроматографія на ДЕАЕ-сефадаксі і SP-сефадаксі, афінна хроматографія на конканавалін-А-сефарозі | П’ять ендоглюконаз, що відрізняються Mr, pl, складом вуглеводів, кінетичними параметрами. |
| Irpex lacteus | Гель-фільтрація через Біогель Р-100, хроматографія на ДЕАЕ-сефадексі | Ендоглюконаза з Mr 15500, низьким вмістом вуглеводів |
| Humicola insolens | Осадження сульфатом амонію, адсорбція на авіцелі, гель-фільтрація на Сефадексах G-50, G-100, хроматографія на ДЕАЕ-сефадексі | Ендоглюконаза з високою термостабільністю і високим вмістом вуглеводів (39%) |
| Termoascus aurantiacus | Осадження сульфатом амонію, гель-хроматографія на Сефадексі G-100, препаративний електрофорез | Три термостабільні ендоглюконази, що відрізняються Mr, pl, вмістом вуглеводів |
| Trichoderma viride | Фракційне осадження сульфатом амонію, афінна хроматографія на порошковій целюлозі, хроматографія на ДЕАЕ-сфероні, хроматофокусування | Шість ендоглюконаз, що відрізняються вмістом вуглеводів, адсорбційною здатністю на целюлозі та лігніні |
| Clostridium thermocellum | Осадження сульфатом амонію, хроматографія на ДЕАЕ-сефадексі і SP-сефадексі | Ендоглюконаза з Mr 80 кДа |
| Talaromyces emersoni | Осадження сульфатом амонію, гель-фільтрація через Сефадекс G-150, хроматографія на ДЕАЕ-сефадексі, препаративний електрофорез | Чотири ендоглюконази з однаковою специфічністю, активністю, що відрізняються pl, Mr, вмістом вуглеводів |
| Trichoderma reesei L27 | Іонообмінна хроматографія на ДЕАЕ-сефарозі CL-6В рехроматографія в різноманітних умовах елюіювання | Ендоглюконази І-ІІІ, що відрізняються pl і вмістом вуглеводів |
| Scierolium rolfsii | Адсорбція на Авіцелі, гель-фільтрація на Біогелі Р-150, препаративне ізоелектрофокусування | Три ферменти з однаковою Mr і різними pl |
| Schisophillum commune | Осадження сульфатом амонію, гель-фільтрація через Біогель Р-150 | Ендоглюконази з pl, що знаходиться в лужному середовищі |
Таблиця 9.2
Очистка і характеристика целобіогідролаз із мікробних джерел [11]
| Мікроорганізм - продуцент | Методи виділення і очистки | Характеристика |
| Humicola insolens | Адсорбція на МКЦ, десорбція при рН 9,0, хроматографія на Сефадексах G-50 і G-100, хроматографія на ДЕАЕ-сефадексі | Містить 26% вуглеводів, підвищена адсорбційна здатність, термостабільність |
| Trichoderma reesei | Іонообмінна хроматографія на ДЕАЕ-сефарозі, препаративне ізоелектрофокусування | Виділено дві целобіогідролази, що відрізняються рІ, складом вуглеводів |
| Penicillium funiculosum | Іонообмінна хроматографія на ДЕАЕ-сефадексі, препаративне ізоелектрофокусування | Містить 9% нейтральних вуглеводів |
| Termoascus aurantiacus | Фракційне осадження сульфатом амонію, гель-хроматографія на Сефаадексі G-100, препаративний дискелектрофорез | Низький вміст вуглеводів, висока термостабільність |
| Geotrichum candidum | Іонообмінна хроматографія на ДЕАЕ-сефадексі, ізоелектричне фокусування на колонці | Фермент з рІ 5,9 і Mr 63 кДа |
| Trichoderma viride | Фракційне осадження сульфатом амонію, афінна хроматографія на порошковій целюлозі, хроматографія на ДЕАЕ-сфероні, преперативне ізоелектрофокусування в гелі | Різноманітні форми целобіогідролаз з рІ 3,8; 4,0; 4,2; подібна субстратна специфічність |
| Acetivibris celluloyticus | Препаративний гель-електрофорез | Фермент з Mr38 кДа |
| Tricoderma viridereesei | Іонообмінна хроматографія на Сфероні-P і ДЕАЕ-сефадексі, гель-електрофорез | Визначений амінокислотний склад фермента,N-кінцеві амінокислоти |
| Sclerotium rolfsii | Хроматографія на Сефадексі G-75 і ДЕАЕ-сефадексі, гель-електрофорез | Висока термостабільність, висока активність за целюлозою |
| Trichoderma reesei | Афінна хроматографія, хроматографія на ДЕАЕ-сефарозі і SP-сефадексі | Целобіогідролаза ІІ, вивчена субстратна специфічність |
| Fusarium lini | Фракційне осадження сульфатом амонію, ізоелектрофокусування | Ферменти, що відрізняються біохімічно і за субстратною специфічністю |
Таблиця 9.3
Очистка і характеристика целобіаз із мікробних джерел [11]
| Мікроорганізм - продуцент | Методи виділення і очистки | Характеристика |
| Aspergillus tеreus | Осадження сульфатом амонію, іонообмінна хроматографія на ДЕАЕ-целюлозі і SР-сефадексі, сефадексі G-200 | Фермент, що володіє целобіазною і арил-β-глюкозидазною активностями |
| Aspergillus aculeatus | Осадження етанолом, хроматографія на ДЕАЕ- і SР-сефадексі, гель-фільтрація на Сефакрилі S-200 і ізоелектрофокусування | Виділено з β-глюкозидази, є глюкопртеінами.Дві здатності розщеплювати целоолігосахариди |
| Trichoderma koningii | Хроматографія на Ультрагелі АсА-44, іонообмінна хроматографія на ДЕАЕ- і SЕ-сефадексі, конканавалін-А-сефа-розі | Вивчена субстратна специфічність двох целобіаз по відношенню до целоолігосахаридів |
| Aspergillus niger | Осадження сульфатом амонію, гель-фільтрація на Сефакрилі S-200 | Фермент складається з двох субодиниць з Mr 84 кДа |
| Trichoderma reesei | Фракційне осадження сульфатом амонію, афінна хроматографія на порошковій целюлозі, хроматографія на ДЕАЕ-сефадексі, сефакрилі S-200 | Фермент проявляє целобіазну і β-глюкозидазну активність |
| Humicola insolens | Гель-хроматографія на Сефадексі G-50 і G-100, іонообмінна хроматографія на ДЕАЕ-сефадексі | Містить 2,5% вуглеводів |
| Geotrichum candidum | Гель-фільтрація на Сефадексі G-50, ізоелектрофокусування на колонці, хроматографія на Cефадексі G-200 і ДЕАЕ-сефадексі | 8 целобіаз і β-глюкозидаз зі змішаню субстратною специфічністю |
Целобіогідролаза відщеплює целобіозу (основний продукт) з кінця полімерних молекул нативної або частково гідролізованої целюлози, іноді разом із целобіозою утворюється невелика кількість глюкози (мінорний продукт), а також інші целоолігосахариди. Целобіаза (β-глюкозидаза) відщеплює кінцеві нередукуючі залишки β-D-глюкози. Фермент може гідролізувати β-D-глюкозиди та целобіозу, при чому швидкість гідролізу зменшується із збільшенням кількості залишків глюкози в целоолігосахариді.
9.2.2. Технологічні особливості застосування целюлаз у процесах біоконверсії целюлози. Відомі різні модифікації реакторів для проведення ферментативного гідролізу целюлози. Їх умовно можна розділити на три типи: реактор періодичної дії (як правило з перемішуванням), проточний реактор з перемішуванням (часто з ультрафільтраційною мембраною) і проточний колонний реактор безперервної дії (різновиди реакторів наведені на рис. 9.2).
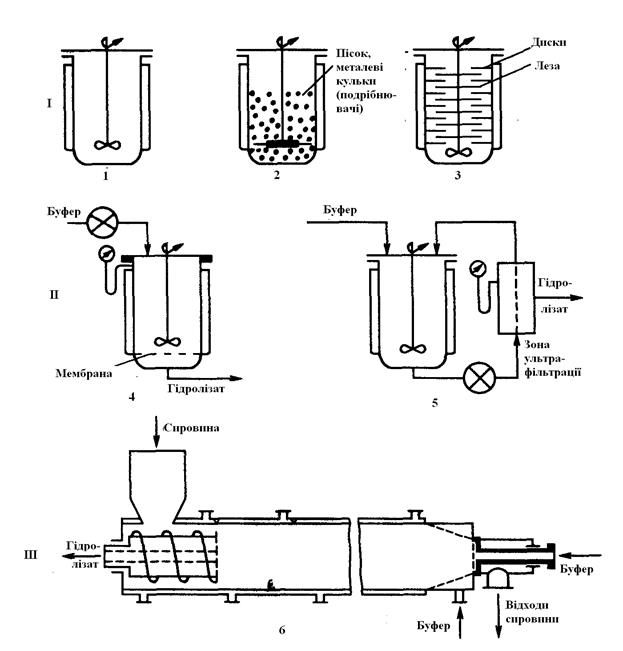
Рис. 9.2. Реактори, які використовуються для ферментативного гідролізу з перемішуванням(І), ультрафільтрацією(ІІ), поршневої течії(ІІІ): 1 – традиційний, 2 – стирання; 3 – зрізання; 4 – з вбудованою ультрафільтраційною мембраною, який працює під тиском; 5 – з виносною зоною ультрафільтрації; 6 – протиточний реактор колонного типу.
Найчастіше використовується реактор періодичної дії з перемішуванням, у який поміщають субстрат і розчин целлюлазного препарату, а процес гідролізу ведеться протягом певного часу з однієї й тією же вихідною порцією субстрату й ферменту. За такої конструкції реакторів виникає проблема відокремлення продуктів реакції від ферментів, а також відокремлення непрогідролізованого залишку сировини. Крім того, швидкість реакції значно зменшується згодом через інгібування продуктами – глюкозою і целобіозою – та інактивації ферментів при перемішуванні. Для відводу продуктів із зони реакції запропоновано використовувати ультрафільтрацію і додавати в реактор у міру гідролізу свіжі порції субстрату. При цьому ферменти затримуються ультрафільтраційною мембраною і залишаються в реакторі, що дозволяє продовжити строк їхньої дії. Ультрафільтраційні мембрани бувають вбудованого типу (тобто перебувають у зоні реактора, де проводиться гідроліз), а також можуть бути виконані у вигляді виносного модуля (рис. 9.2, 5). Використання реакторів мембранного типу ІІ доцільно здійснювати в режимі з підживленням сировини. Реактори здрібнювання являють собою різновид реактора перемішування й дозволяють збільшити у 1,5...2,0 рази ефективність ферментативного гідролізу, хоча мають ті ж недоліки, що й реактор перемішування. Відомий реактор здрібнювання (стирання), що представляє собою реактор перемішування, обладнаний мішалкою із циліндричними сталевими пальцями замість лопат, на 2/3 обсягу заповнений подрібнюючим матеріалом (піском, скляними або сталевими кульками).
Одним з варіантів реактора перемішування є реактор зрізання (рис. 9.2, 3). На валу пропелерної мішалки реактора додатково через рівні проміжки жорстко закріплені диски з отворами, а на внутрішній стінці циліндричного реактора через ті ж проміжки жорстко кріпляться аналогічні перфоровані диски. Диска-леза ротора й статора чергуються, їхній діаметр трохи менше, ніж внутрішній діаметр реактора. Він призначений для гідролізу ЦСМ із розміром часток 0,25...25 мм. У колонних реакторах безперервного типу дії (витиснення або поршневого типу, див рис. 9.2, ІІІ) процес гідролізу здійснюється під дією ферментів, міцно адсорбованих на поверхні субстрату, а розчинні продукти реакції віддаляються з його обсягу потоком буфера. У колонних реакторах концентрація субстрату зазвичай в 2...4 рази вища, ніж у реакторах з перемішуванням і може досягати 200...400 г/л.
Дата добавления: 2016-04-02; просмотров: 2728;
