III. Хирургическая стадия
ТЕОРИИ НАРКОЗА
Исследователями предложен ряд теорий, объясняющих своеобразный эффект общих анестетиков. По сути, эти концепции являются гипотезами, а термин "теория" употребляют, отдавая должное истории проблемы.
Предпосылкой для создания одной из первых теорий — коа-гуляционной теории (Кюн, 1864; Клод Бернар, 1875) — явилось свойство диэтилового эфира и хлороформа вызывать своеобразное свертывание внутриклеточного белка с образованием зернистости впротоплазме. Эти изменения рассматривали в качестве основной причины нарушения функции клетки. Позже исследователи выяснили, что отмеченные изменения возникают при условии, если концентрация анестетиков в тканях значительно превышает уровень, достигаемый в клинических условиях.
Известно, что клеточные мембраны и нервные клетки содержат большое количество липоидов, а анестетики обладают высокой степенью тропности к липоидам. На этих фактах базировалось возникновение липоидной теории (Герман, 1866; Мейер, Овертон, 1899—1901), согласно которой, насыщение клеточных мембран анестетиками создает барьер для нормального обмена веществ в клетке. Определенным подтверждением справедливости данной гипотезы считали зависимость степени выраженности наркотического эффекта (силы действия) анестетиков от степени их тропности к липоидам (закон Мейера—Овертона). В дальнейшем ученые выяснили, что такая закономерность характерна лишь для большинства ингаляционных анестетиков. Были обнаружены исключения, поэтому липоидная теория оказалась не универсальной.
Теория поверхностного натяжения (Траубе, 1913) основывалась на данных о том, что липотропные анестетики обладают свойством снижать поверхностное натяжение на границе между липоидной оболочкой клетки и окружающей ее жидкостью, вызывая повышение проницаемости мембраны.
Сторонники адсорбционной теории (Лове, 1912) утверждали, что анестетики оказывают наркотическое действие благодаря высокой сорбционной способности в отношении внутриклеточных липоидов в коллоидном состоянии и свойству повышать проницаемость клеточных мембран. Предполагали, что специфическая функция нервных клеток блокируется вследствие высокого насыщения анестетиком их липопротеиновых структур.
Теория критического объема (Варбург, 1911) объясняла интересный феномен устранения анестезии под действием повышенного давления. Известно, что бимолекулярный слой фосфолипидов в клеточных мембранах нейронов имеет в составе множество гидрофобных структур. Согласно теории критического объема, анестетики, связываясь с гидрофобными структурами мембраны нейронов, расширяют фосфолипидный бимолекулярный слой до критического объема, после чего функция мембраны претерпевает изменения, и, возможно, повышенное давление вытесняет часть молекул анестетика из мембраны, увеличивая потребность в нем.
Данные об ингибирующем влиянии анестетиков на ферментные комплексы, которые занимают ключевое положение в обеспечении окислительно-восстановительных процессов в клетках, привели к формированию гипоксичеекой теории (Фер-ворн, 1912) обшей анестезии. Приверженцы этой теории утверждали, что торможение функции ЦНС при насыщении анестетиками возникает в результате нарушения энергетики клеток. Позже исследователи выяснили, что в условиях обшей анестезии клеточный метаболизм нарушается не всегда, а характерные для гипоксии метаболические изменения в клетке обычно возникают лишь при концентрации некоторых анестетиков в тканях, значительно превышающей используемую концентрацию в клинических условиях. Также не было получено убедительных данных о снижении потребления клетками кислорода, не объяснено быстрое восстановление функций нейронов после удаления из них анестетика; с теорией во многом не согласовались показатели КОС тканей и оттекающей от ЦНС крови.
В 1961 году Полинг предложил теорию водных микрокристаллов, согласно которой наркотическое состояние развивается благодаря свойству общих анестетиков образовывать в жидкостной фазе тканей своеобразные кристаллы, создающие пре-
пятствие для перемещения катионов через мембрану клетки, тем самым, блокируя процессы деполяризации и формирование потенциала действия. Дальнейшие исследования показали, что свойством кристаллообразования обладают не все общие анестетики; те же из них, для которых характерен этот феномен, образуют кристаллы при концентрациях, превышающих используемые в клинической практике.
Наибольшее признание и развитие получила мембранная теория общей анестезии (Хобер, 1907; Бернштейн, 1912; Винтерштейн, 1916; Ходжкин, Кац, 1949). Она базировалась на данных о влиянии анестетиков на проницаемость мембран нервных клеток. Основой теории явились результаты исследований по формированию потенциала действия и распространению возбуждения в пределах одного нейрона и в межнейронных контактах. Было установлено, что перемещение через мембрану ионов калия (К+) и натрия (Na+) при раздражении клетки происходит неравномерно: выходу К+ из клетки предшествует интенсивный ток Na+ в клетку. При этом в зоне раздражения на мембране клетки возникает обратное обычному распределение зарядов: снаружи электрический заряд становится отрицательным, а с внутренней поверхности — положительным. Возникающий на границе возбуждения потенциал значительно превышает потенциал покоя, что и обусловливает его способность распространять возбуждение. Следующая фаза сопровождается затратой АТФ: ионы калия возвращаются в клетку, ионы натрия — извлекаются из нее (катионный насос). В механизме перехода клетки из состояния покоя в состояние возбуждения с последующим восстановлением трансмембранного потенциала покоя важную роль играют ионы кальция (Са++): под их влиянием изменяется интенсивность тока К+ и Na+ через мембрану во время ее деполяризации и восстановления потенциала покоя.
В дальнейшем было установлено, что общие анестетики оказывают выраженное тормозящее действие на синаптическую передачу в дозах, которые существенно не влияют на распространение возбуждения по мембране нейрона. Для торможения распространения потенциала действия по мембране необходимы более значительные концентрации анестетика, хотя сам механизм торможения в том и другом случае аналогичен.
Синапсы являются одним из наиболее сложных звеньев рефлекторной цепи и подвержены влиянию различного рода эндогенных и экзогенных факторов, поэтому тормозящее влияние анестетиков на передачу импульсов в синапсах выражено более, чем на мембранах нейронов. Механизм угнетения возбудимости нейронов и торможения синаптической передачи возбуждения под влиянием анестетиков полностью не раскрыт. Известно, что различные анестетики неодинаково влияют на основные функциональные звенья синапсов, например, они могут нарушать образование и высвобождение медиатора через пресинаптическую мембрану в синаптическую щель, или угнетать обратный захват медиатора, или снижать чувствительность рецепторов пресинаптической и постсинаптической мембран к медиатору, или приводить к угасанию постсинаптического потенциала действия, вызывая изменения тока ионов через мембрану. При всей ценности сведений о тонких механизмах действия анестетиков на клеточном и молекулярном уровнях, мембранная теория не раскрывает сущности обшей анестезии как своеобразного функционального состояния нервной системы организма, поскольку в клинических условиях используемая концентрация анестетиков не вызывает полной ареактивности нейронов и блокады синаптической передачи, а лишь оказывает тормозящее влияние на их функцию.
Эффект многих общих анестетиков объясняют их действием на специфические рецепторы медиаторов ЦНС — ацетилхолина, катехоламинов, серотонина,
гамма-аминомасляной кислоты (ГАМК), адснозина, аспартата глютамата эндо генных опиатов, цАМФ и др. Многие анестетики усиливают опосредованную гам-ма-аминомасляной кислотой депрессию ЦНС. Более того, агонисты ГАМК-ре-цепторов углубляют анестезию, в то время как антагонисты устраняют многие эффекты анестетиков. Возможно, влияние на функцию ГАМК является одним из главных механизмов действия многих анестетиков.
Особого внимания заслуживает теории парабиоза (1901). Ее автор, Введенский Н Е пришел к заключению, что анестетики действуют на нервную систему как сильные раздражители и вызывают соответствующие фазы парабиоза, которые характеризуются последовательным снижением физиологической лабильности отдельных нейронов и нервной системы в целом. Согласно теории парабиоза, при определенном уровне насыщения мозга анестетиком снижение лабильности механизмов, лежащих в основе формирования и распространения нервных импульсов, достигает степени торможения функций ЦНС и клинически проявляется состоянием общей анестезии. В дальнейшем теория парабиоза получила развитие в трудах Ухтомского А.А. и его последователей в 1950—1960-е годы.
Концепция изменений физиологической лабильности нейронов и, особенно, синапсов под ачиянием наркотических веществ позволила приблизиться к пониманию, что в каждое мгновение процесса общей анестезии степень торможения функции различных отделов мозга оказывается неодинаковой, так как неодинакова исходная функциональная лабильность отделов мозга. Такая версия нашла убедительное подтверждение в следующем факте: наиболее подверженными тормозящему влиянию анестетиков оказались функции коры больших полушарий и ретикулярной формации. Это явилось предпосылкой для разработки ретикулярной теории общей анестезии. Известно, что ретикулярная формация играет активирующую роль в отношении вышележащих отделов ЦНС. Разрушение определенных зон ретикулярной формации вызывает состояние, близкое к медикаментозному сну или наркозу. Эти факты дали возможность сделать заключение о вероятной связи специфического действия наркотических веществ на функцию ретикулярной формации. Таким образом, сформировалось представление, что эффект общих анестетиков является результатом торможения рефлекторных процессов на уровне ретикулярной формации (устраняется ее восходящее активизирующее влияние, что приводит к деафферентации вышележащих отделов ЦНС). Несмотря на убедительные данные ретикулярной теории общей анестезии, результаты некоторых исследований свидетельствуют, что она во многом упрощена и не может быть признана универсальной, тем более что влияние анестетиков на активность нейронов ретикулярной формации разнообразно и может повышать, уменьшать или не изменять ее функции (в зависимости от действующего вещества). Вероятно, что изменение активности ретикулярной формации при анестезии связано со специфическим взаимодействием общих анестетиков с определенными структурами в каждом отделе ЦНС. Кроме того, состояние уровня сознания не определяется одной лишь активностью ретикулярной формации.
Клинические концентрации анестетиков угнетают спонтанную и вызванную активность в различных отделах ЦНС: коре головного мозга, гиппокампе, спинном мозге и др. Анестетики оказывают одновременное действие на многие области ЦНС, и анестезия не возникает от воздействия анестетиков на отдельные специфические отделы ЦНС. Нервная система человека состоит из биллионов ней-ронов, каждый из них имеет тысячи синапсов, поэтому не удивительно, что действие анестетиков имеет такую сложную и разнообразную природу.
СТАДИИ НАРКОЗА
При введении в организм общих анестетиков установлена закономерная стадийность в клинической картине общей анестезии, которую наиболее четко прослеживают при использовании эфира. Проявления наркотизации другими анестетиками развиваются аналогично, но разделение проявлений по стадиям менее выражено. Знание клинической картины каждой из стадий помогает анестезиологу при проведении общей анестезии. Наиболее широкое распространение получила классификация стадий наркоза Гведела А., модифицированная Жоровым И.С. (рис. 2.1).
Классификация стадий наркоза (по Гведелу А.):
I. Стадия аналгезииначинается с момента вдыхания паров эфира. Через не
сколько минут наступает потеря сознания: речь становится бессвязной, появля
ется сонливость. Кожа лица гиперемирована. Зрачки исходной величины или
расширены, реагируют на свет. Дыхание учащено, неритмичное. ЧСС увеличе
на, АД несколько повышено. Тактильная и температурная чувствительности со
хранены, болевая — ослаблена, что позволяет проводить кратковременные ма
нипуляции.
II. Стадия возбужденияначинается сразу после потери сознания и характери
зуется речевым и двигательным возбуждением. Кожа гиперемирована. Веки сомк
нуты, зрачки расширены, фотореакция сохранена, ресничный рефлекс отсутству
ет; появляются слезотечение и плавательные движения глазных яблок. Дыхание
частое, аритмичное. ЧСС и АД повышены. Кашлевой и рвотный рефлексы усиле
ны. Мышцы напряжены, тризм. При стимуляции гортани и глотки возможен ла-
рингоспазм. Во время этой стадии может развиться фибрилляция желудочков сер
дца, редко — непроизвольное мочеиспускание, рвота.
III. Хирургическая стадия
III1.На фоне спокойного сна еще сохранены мышечный тонус и гортанно-глоточные рефлексы. Зрачки сужены, реагируют на свет; роговичный рефлекс сохранен; медленные движения глазных яблок. Дыхание ровное, несколько учащенное. ЧСС повышена, АД на исходном уровне.
Ш2. Кожа розовая, слизистые влажные. Зрачки сужены, фотореакция сохранена; роговичный рефлекс отсутствует; глазные яблоки фиксированы. Дыхание ровное. ЧСС и АД на исходном уровне. Гортанный и глоточный рефлексы отсутствуют. Мышечный тонус снижен.
III3. Появление признаков токсического действия анестетика.Кожа бледно-розовая. Зрачки расширены, фотореакция ослаблена; сухость роговицы. Дыхание диафрагмальное, учащенное. ЧСС увеличена, АД понижено. Мышечный тонус снижен.
Ш4. Появление признаков передозировки анестетика.Кожа бледно-цианотичная. Зрачки резко расширены, фотореакция отсутствует. Сохранено только диафрагмальное дыхание — поверхностное, аритмичное. ЧСС резко повышена, пульс частый, нитевидный; АД резко понижено. В случае продолжения поступления анестетика происходит дальнейшее угнетение дыхания и кровообращения и развивается терминальное состояние. Этот уровень недопустим в клинической практике.
IV. Стадия пробуждения наступает после прекращения поступления анестетика и характеризуется постепенным восстановлением рефлексов, мышечного тонуса, чувствительности и сознания в обратном порядке.
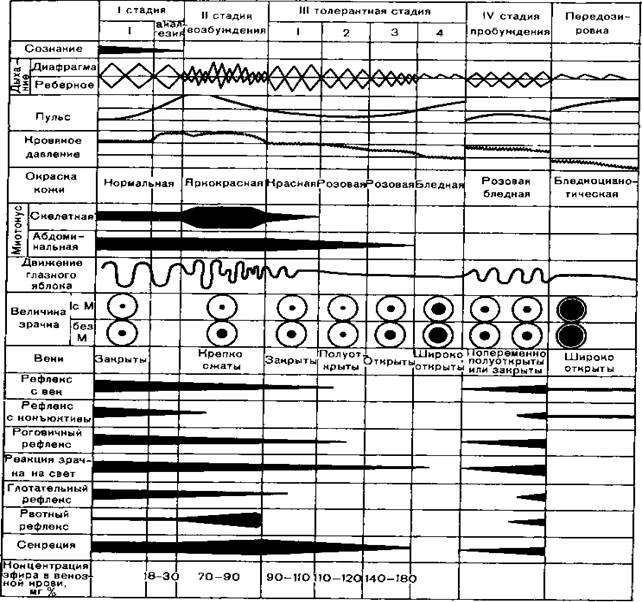
Рис. 2.1. Классификация стадий наркоза (по Гведелу А.)
2.3. КОНЦЕПЦИИ АНЕСТЕЗИОЛОГИЧЕСКОГО ОБЕСПЕЧЕНИЯ ОПЕРАЦИЙ
Любое оперативное вмешательство, выполняемое по жизненным показаниям с самыми благими намерениями, тем не менее, является определенной формой агрессии, на которую организм реагирует комплексом сложных гоме-остатических процессов. Общий адаптационный синдром, как итоговое проявление стресс-реакции, развивается при любых операциях и проявляется в различной степени.
До определенного исторического периода главной задачей анестезии считали лишь устранение болевых ощущений. Долгое время этого было вполне достаточ но, так как хорошее обезболивание позволяло хирургам в значительной степени расширить спектр выполняемых операций. В последующем, когда оперативные доступы к большинству органов человеческого тела были разработаны возникла необходимость решать проблемы не только анатомические, но и анатомо-функ-циональные. При этом уже стало возможным рассчитывать не только на силы больного, но и искусственно помогать организму преодолевать опасные функциональные расстройства, возникающие во время операции и в ближайший послеоперационный период. Анестезия стала включать в себя элементы функциональной терапии, которые приобрели решающее значение при большинстве обширных операций, а у тяжело больных — при любых вмешательствах. Именно эти факты позволили наркотизаторам (эфиродателям) трансформироваться в специалистов широкого профиля.
Многочисленными исследованиями установлено, что нейрофизиологические механизмы боли достаточно сложны. Оказалось, что устранение лишь перцепту-ального компонента болевой реакции (психоэмоционального ощущения боли) далеко не исчерпывает всей полноты последствий, которые развиваются в ответ на повреждение; невозможно предупредить развитие нейрогуморальных реакций в ответ на тяжелую травму (операцию) за счет локальной активации той или иной структуры нервной системы, так как воздействие на корковые и подкорковые образования, ответственные за формирование ноцицептивной импульсации (суп-расегментарный уровень), не исключает реализации сегментарного ответа через мотонейроны задних рогов спинного мозга. Периферическая (первичная) гипер-алгезия снижает эффективность узких сегментарных (спинальных) воздействий и блокирует проведение импульсации по первичным афферентам (регионарные методы анестезии). Все это привело к пониманию необходимости придания анестезии многоуровнего характера,предусматривающего воздействие на различные участки нервной системы: рецепторного поля, первичных афферентов, сегментарного и супрасегментарного уровней.
Полное подавление ноцицепции с помощью медикаментозных средств у живого человека, в принципе, недостижимо. Анестезиологу подвластны лишь модуляция ноцицептивного потока, а также снижение информационного паттерна других факторов агрессии (кровопотери, гипоксемии, ацидоза и пр.) с целью уменьшения выраженности ответной реакции организма на травму. Следовательно, при сильном возбуждающем начале ответная реакция неизбежна и она обратно пропорциональна эффективности защиты. Примером крайнего варианта плохой зашиты может служить развитие шока при ранениях и травмах. В то же время выполнение плановых хирургических вмешательств в больничных условиях, которые по тяжести агрессии можно приравнять к ранениям и травмам, на фоне адекватной анестезии не сопровождаются критическими расстройствами систем жизнеобеспечения, хотя и проявляются общим адаптационным синдромом. Соответственно, ухудшение качества анестезии смещает вектор стресс-реакции в ст -рону крайне негативных проявлений.
При определении полноценности анестезии было бы ошибкой ограничивать ее только адекватностью аналгетического компонента. Необходимо учитывать, обший поток возмущающей импульсации, идущей в ЦНС при повреждении стоит из мультимодальной афферентации от ноцицепторов, баро-, хемо- и прочих-рецепторов, реагирующих на изменение внутренней среды организма при травме
(разрезе) тканей, кровотечении, изменении кровотока, кислотно-основного со стояния и т. д. Это диктует необходимость комплексного подхода к защите кото" рый ориентирован на поддержание различных гомеостатических процессов во время операции, тем более в случаях, когда в результате патологического процесса наступило истощение адаптационных возможностей организма. Поэтому в процессе анестезии важно не только уменьшать или устранять гемодинамические расстройства и обеспечивать антиноцицептивную защиту, но и осуществлять реализацию плана интенсивной терапии, если ее проводили в предоперационный период
Известно, что проявления стресс-реакции реализуются в виде нейрогенного и гуморального ответов. Модуляция обоих без устранения причины малоэффективна. Накоплены данные в отношении первичной периферической сенситизации и вторичной центральной гипералгезии (по терминологии академика Крыжановс-кого Г.Н. — патологической алгической системы), предусматривающие возможность повторной стимуляции ноцицептивных рецепторов. Эти факторы являются базисными для упреждающего подхода в анестезиологической практике, направленного на предотвращение чрезмерной активации нейрогуморальных механизмов.
Таким образом, современные представления о патофизиологии боли и формировании стресс-реакции в ответ на травму (операцию) обусловливают ряд положений, имеющих принципиальное значение для обоснования тактики анестезии:
• основные усилия анестезиолога должны быть направлены на афферентное
звено рефлекторной дуги, а также на уменьшение ятрогенной активации механиз
мов, ответственных за эфферентную импульсацию;
• устранение психоэмоционального ощущения боли необходимо сочетать с
блокадой вегетативного нейронального и двигательного компонентов ноцицеп-
тивной афферентации и с активацией антиноцицептивной системы путем соче-
танного использования общих и местных анестетиков с аналгетиками;
• в процессе анестезии необходимо минимализировать угнетение физиоло
гических механизмов антиноцицепции и реактивности основных регуляторных
систем;
• рассматривая действия хирурга в операционной ране как дополнительное
повреждение, и учитывая способность ноцицептивной системы к самоактивации,
следует добиваться деафферентации и включения антиноцицептивной системы до
нанесения травматического воздействия;
• анестезию у тяжело больных необходимо объединять единой тактикой и
стратегией с интенсивной терапией, проводимой анестезиологом в пред- и после
операционном периодах.
Цели современной анестезиологической помощи: обеспечить психическое (эмоциональное) спокойствие больного, исключить "присутствие пациента на собственной операции", предотвратить сопутствующие боли эмоциональные реакции; устранить перцептуальный компонент боли, снизить до безопасного (нестрессового) уровня интенсивности ноцицептивный поток из операционной раны по всему пути его следования (от периферических рецепторов до центральных структур мозга); предупредить нежелательные патологические рефлексы и чрезмерное напряжение деятельности функциональных систем; поддержать и, при необходимости, откорректировать деятельность систем жизнеобеспечения; создать удобные условия хирургу для работы (положение больного на операционном ст -ле, мышечное расслабление, коллабирование легкого и т. п.).
Для решения этих целей используют наркоз ("обездушивание" ), аналгезию, нейровегетативную защиту, выключение двигательной активности, различные
методы интенсивной терапии (ИВЛ, инфузионно-трансфузионную, кардиотроп-ную. сосудистую терапии и др., в том числе специфические, применяемые в специализированных областях хирургии). Полнота использования этих приемов и способы достижения конечного результата зависят от конкретной ситуации (заболевания, индивидуальных особенностей пациента и его состояния, характера оперативного вмешательства и т. п.). В совокупности эти факторы определяют принцип избирательной регуляциифункций в процессе анестезии, который составляет основу концепции многокомпонентности анестезии(за рубежом употребляют термин "концепция мультимодальности"). Согласно этой концепции, анестезиологическое обеспечение состоит из отдельных компонентов, каждый из которых может быть применен (или не применен) анестезиологом в зависимости от возникающих проблем перед предстоящей операцией. Такой подход обеспечивает гибкость тактики, позволяет легче и качественнее решать конкретные задачи путем применения нескольких средств, оказывающих более или менее направленное и избирательное действие.
Концепция многокомпонентности пришла на смену доминировавшей в течение многих лет концепции глубины анестезии.Она предусматривала решение нескольких задач (выключения сознания, обезболивания, расслабления мышц) за счет последовательного углубления анестезии одним анестетиком и была во многом обусловлена превалированием в арсенале анестезиологов препаратов ингаляционного действия. Реализация ее на практике всегда сопровождалась опасностью передозировки анестетика с распространением торможения на жизненно важные регулятор-ные центры. В настоящее время концепция глубины анестезии устарела, но это не означает, что устарела и сама ингаляционная анестезия. Ориентация на многоком-понентность позволяет использовать ингаляционную анестезию в качестве компонента общей анестезии и применить другие средства и приемы в качестве компонентов для повышения ее эффективности и безопасности.
Новые знания в областях нейрофизиологии боли и формирования общего адаптационного синдрома позволяют детализировать действия анестезиолога в пред-, интра- и ближайший послеоперационный период.
Предоперационный период.Неустраненный предоперационный эмоциональный стресс может привести к значительному снижению болевого порога, выбросу стресс-гормонов с последующей активацией гемодинамических и эндокринных реакций, повышению толерантности к действию анестезирующих средств (Оси-пова Н.А. и др., 1994, 1998). Одним из важнейших моментов в тактике анестезиолога является создание психологического покоя для пациента путем нахождения с ним взаимопонимания, разъяснения сути предстоящей анестезии, адекватной пре-медикации с использованием седативных препаратов (особенно бензодиазепинов). Исключают возникновение боли при выполнении предоперационных инвазивных исследований и манипуляций, особенно непосредственно перед анестезией (в том числе при катетеризации периферических и центральных вен, эпидурального пространства). Травматичные операции предваряют использованием средств, способных уменьшить эффект периферической и центральной сенситизации, — нестероидными противовоспалительными аналгетиками, тормозящими выделение про-стагландина Е2, по показаниям — наркотиками.
Интраоперационный период.Применяют максимально интенсивные воздействия для предотвращения выхода потока ноцицептивной импульсации за разумные пределы. Анестезиолог наделен широкими полномочиями по коррекции стрессовых гемодинамических и других реакций. Это позволяет использовать наиболее
эффективные дозы атарактиков, нейролептиков, центральных аналгетиков (опиатов и опиоидов) и других средств, не опасаясь их побочного действия (депрессии дыхания, снижения АД и пр.). При этом, согласно упреждающему подходу, достигают должной глубины анестезии до нанесения травмирующего воздействия (включая интубацию трахеи), а не по мере появления гемодинамических признаков неадекватности анестезии.
Современный арсенал средств позволяет анестезиологу достигать уменьшения ноцицепции путем использования ингибиторов простагландино- и кининоге-неза (апротинин), блокаторов NMDA-рецепторов (малые дозы кетамина), а также за счет блокады первичных афферентов (местная инфильтрационная и регионарная анестезии). Уделяют внимание коррекции повышенной активности стресс-лимитирующих систем путем введения естественных метаболитов медиаторов, их синтетических аналогов, антиоксидантов, адренопозитивных средств. Многоуровневый характер анестезии позволяет реализовать сочетанная анестезия.
Послеоперационный период. Используют методы, позволяющие обеспечить деафферентацию, например, продленную эпидуральную и другие виды блокад, медикаментозную противоболевую терапию. По возможности избегают применения средств, обладающих супрасегментарным действием (синтетических аналогов эндогенных опиатов), чтобы не мешать центральным механизмам регуляции обеспечивать координирующую роль над гомеостатическими функциями. Природа послеоперационного болевого синдрома во многом обусловлена избыточным простагландино- и кининогенезом в подвергшихся травматизации тканях. Эти процессы могут стать причиной патологического течения раневого процесса (чрезмерный отек, асептическое воспаление оперированных тканей) с развитием осложнений (анастомозиты, несостоятельность швов анастомозов, некрозы), поэтому препаратами первого ряда при выборе медикаментозного обезболивания являются нестероидные противовоспалительные средства, применение которых в подобных ситуациях патогенетически оправдано.
Высокая квалификация анестезиолога помогает разобраться в широком спектре возможностей воздействия на организм пациента и не допустить превращения многокомпонентности в полиинградиентность и полипрагмазию.
Дата добавления: 2016-03-30; просмотров: 1206;
