I-стадия.-.каталитическое окисление аммиака.
4NH3 + 5O2 = 4NO + 6H2O +Q (3.1)
4NH3 + 3O2 = 2N2 + 6H2O +Q (3.2)
4NH3 + 4O2 = 2N2O + 6H2O +Q (3.3)
Кроме реакций (1-3) в контактном аппарате возможно протекание других побочных реакций, снижающих селективность процесса. Так, например, при повышении времени контактирования больше оптимального, возможна термическая диссоциация аммиака:
2NH3  N2 + 3H2 – Q (3.4)
N2 + 3H2 – Q (3.4)
При повышении линейной скорости аммиачно-воздушной смеси, низкой температуре, отравлении катализатора происходит проскок аммиака, что приводит к образованию элементарного азота:
4NH3 + 6NO = 5N2 + 6H2O +Q (3.5)
Таким образом, процесс окисления аммиака до оксида азота (II) является сложным, т.к. наряду с целевым получаются побочные продукты.
О равновесном состоянии основной реакции (1) можно судить по величине константы равновесия, которая при температуре 9000С равна 1053. Известно, что для обратимых реакций константы равновесия имеют значения в пределах 10-2 – 102. Наиболее вероятные побочные реакции 2-3 также имеют значения констант равновесия намного превышающие величину 102. Поэтому процесс окисления аммиака до оксида азота (II) – необратимый.
Энергетическая характеристика: процесс окисления аммиака до оксида азота (II) имеет отрицательный тепловой эффект, идет с выделением теплоты, т.е. является экзотермическим.
Выбор оптимальных условий проведения процесса.
Катализатор.
Реакция (11.1) в объеме не идет даже при высоких температурах из-за большой величины энергии активации. Для реализации этой реакции необходимы катализаторы, активно адсорбирующие кислород. В промышленности чаще всего применяют платиново-родиевые катализаторы. Окисление аммиака на этих катализаторах протекает очень быстро, время контактирования – 10-4 сек, выход при этом составляет 98%.
Неплатиновые катализаторы, состоящие из оксидов железа и хрома, также дают высокие выходы (около 96%), но скорость реакции уменьшается в 100 раз.
Таким образом, процесс окисления аммиака до оксида азота (II) является гетерогенно-каталитическим, идет во внешнедиффузионной области. Лимитирующая стадия – диффузия аммиака к поверхности катализатора.
Помимо активности, катализатор должен обладать селективностью, так как состав конечных продуктов будет определяться соотношением скоростей реакций 3.1 – 3.3.
Температура.
На платиновом катализаторе зависимость выхода NO от температуры имеет максимум, рис. 3.1.
Рис. 3.1. Зависимость практического выхода оксида азота (II) от темепартуры:
1 –при давлении 0,1 МПа, 2 –п 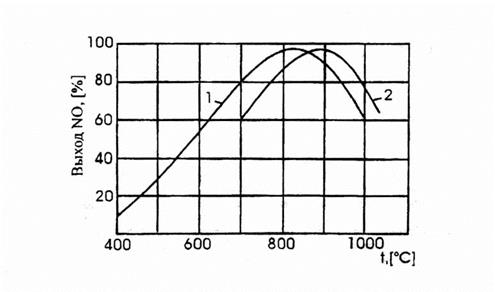
ри давлении 0,8 МПа.
Такой характер кривой определяется влиянием температуры на возможность протекания побочных реакций.
При низких температурах, примерно до 5000С, когда количество адсорбированного кислорода сравнительно невелико, окисление аммиака протекает в основном с образованием элементарного азота. С повышением температуры до 700-8000С выход NO возрастает, так как увеличивается доля активных центров катализатора, занятых кислородом, и растет скорость диффузии исходных веществ к поверхности катализатора. При дальнейшем повышении температуры происходит десорбция кислорода и резко возрастают скорости побочных реакций.
Давление.
Давление в процессе окисления аммиака связано с температурой. Чем выше давление, тем требуется более высокая температура для достижения одного и того же выхода (рис.11.1.).
Проведение процесса под давлением имеет ряд преимуществ: повышается скорость процесса, увеличивается интенсивность катализатора, значительно возрастает скорость реакции:
NO +0,5O2 =NO2 (3.6.),
которая является лимитирующей в производстве азотной кислоты.
В промышленности процесс окисления аммиака до оксида азота (II) проводят при давлении – 0,8 МПа.
4. Соотношение исходных компонентов.
При стехиометрическом соотношении кислорода к аммиаку равном 1,25 в смеси будет содержаться 14,4 об.% аммиака, что соответствует области взрывоопасных концентраций. Кроме этого, при таком соотношении часть активных центров катализатора не заполняется кислородом, что будет способствовать протеканию побочных реакций с образованием элементарного азота.
Дата добавления: 2016-03-27; просмотров: 5085;
