В) среднее окисление
Окисление перманганатом калия - реакция Вагнера (русский химик - Егор Егорович Вагнер, 1885г.): алкены окисляются перманганатом калия в нейтральной или слабощелочной среде при комнатной температуре с образованием двухатомных спиртов (диолов):
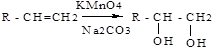
Реакция используется как тест на присутствие в соединении кратных С=С-связей.
Озонолиз: алкены взаимодействуют с озоном с образованием озонидов, при гидролизе которых образуются карбонильные соединения и пероксид водорода:
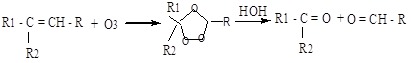
Восстановительный гидролиз озонида проводят в присутствии восстановителей (например, Zn), чтобы избежать окисления альдегидов пероксидом водорода.
Озонолиз алкенов позволяет определить их состав и положение в молекуле двойной связи.
г) сильное окисление(перманганат калия в кислой среде, хромовая смесь, оксид хрома (VI), азотная кислота).
При окислении образуются карбоновые кислоты (или кетоны), при этом концевая метиленовая группа СН2 окисляется до СО2:
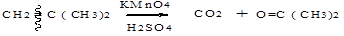
3. Радикальное замещение водорода в аллильном положении. Галогенирование, напримерпропена хлором при высоких температурах приводит к образованию продукта замещения:
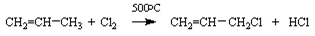
4. Полимеризация. Реакции полимеризации сопровождаются образованием алканов с высокой молекулярной массой.
Схема полимеризации этилена:
n СH2=СН2 → (-СH2-СН2-)n
мономер полимер n - степень полимеризации
этилен полиэтилен
n СH2=СН-СН3 → (-СH2-СН(СН3)-)n
пропилен полипропилен
Полимеризация - процесс каталитический. Для промышленного получения полимеров осуществляют радикальную, анионную и катионную полимеризацию.
Применение алкенов:
1. сырье для для промышленности тонкого и основного синтеза (спирты, карбоновые кислоты, карбонильные соединения и т.д.);
2. получение экологически безвредных средств борьбы с вредными насекомыми в сельском хозяйстве;
3. получение высокомолекулярных соединений (полиэтилен, полипропилен и т.д.).
Знаете ли вы, что
-Олефины - «маслородные», некоторые продукты превращений, например 1,2-дихлорэтан представляют собой маслянистые жидкости.
-Этилен («воздух Бехера» со слабым чесночным запахом) открыт Бехером в 1669г. действием серной кислоты на этиловый спирт. Состав этого соединения определили через 100 лет, а ещё через 100 лет представили его формулу - СН2=СН2.
-Дегидрогалогенирование - (де+гидро+галоген+ирование = удалять+водород+галоген+действие).
-К. Циглер и Дж. Натт - лауреаты Нобелевской премии, открыли и внедрили в промышленность катализаторы, позволяющие получать в мягких условиях полимеры с высокой молекулярной массой, с регулярным строением и отличными техническими характеристиками.
-Этилен применяют в качестве вещества, ускоряющего созревание овощей и фруктов. Он выделяется и при созревании яблок, поэтому яблоки часто кладут рядом с овощами и фруктами.
Алкадиены
Алкадиены – это углеводороды, содержащие две С=С-связи . Общая формула алкадиенов СnH2n-2. Классифицируют алкадиены по расположению двойных связей в молекуле:
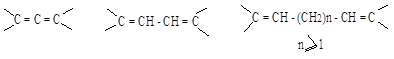 кумулированные сопряженные изолированные
кумулированные сопряженные изолированные
 Номенклатура. Названия алкадиенов образуют от названий алканов, заменяя суффикс -ан на -диен.
Номенклатура. Названия алкадиенов образуют от названий алканов, заменяя суффикс -ан на -диен.
Простейшие углеводороды имеют тривиальные названия: СН2=С=СН2 - аллен, СН2 =СН-СН=СН2 - дивинил, СН2=С(СН3)-СН=СН2 - изопрен.
Диены с изолированными связями по строению и свойствам мало отличаются от алкенов. Кумулированные и сопряженные диены обладают рядом специфических свойств. Наибольший интерес представляют сопряженные диены.
Нахождение в природе. Изопреновый фрагмент присутствует в структуре многих природных соединений, например натурального каучука, гуттаперчи, терпенов, каротина, холестерина и т. д.
Основные области применения алкадиенов указываются при рассмотрении свойств этих соединений.
Получение сопряженных диенов.Сопряженные алкадиены получают различными реакциями отщепления из алканов и алкенов, спиртов, галогенпроизводных углеводородов.
1. Способ С.В. Лебедева
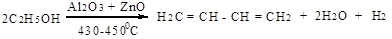
2. Дегидрирование бутан-бутеновой фракции переработки нефти:
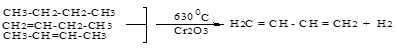
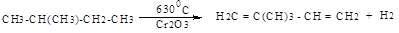
Мировое производство бутадиена-!,3 и изопрена составляет более десятка миллионов тонн в год, они широко используются в производстве синтетических каучуков.
Изомерия.
1. Структурная
Для диеновхарактерны следующие виды:
а) различное строение углеродной цепи (для углеводородов с числом атомов углерода ≥ 4);
б) различное расположение кратной связи (для углеводородов с числом атомов углерода ≥ 4);
в) межклассовая.
Межклассовыми изомерами алкадиенов могут быть алкины, циклоалкены.
2. Геометрическая изомерия:
Геометрическая изомерия характерна для сопряженных диенов, у которых в концевых СН2-группах атомы водорода замещены на другие атомы или радикалы:
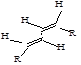
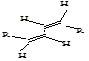
транс, цис-изомер цис, цис-изомер
Сопряженные алкадиены могут существовать в двух пространственных формах (конформациях):

s-цис-форма s-транс-форма
s-транс-формастабильнее (95%) s-цис-формы.
Строение алкадиенов.Строениеизолированных диенов практически не отличается от алкенов.
В кумулированных диенах центральный атом углерода находится в sр-гибридизации, что и определяет пространственную форму этих соединений. Кумулированные диены не стабильны и при нагревании изомеризуются в алкины.
В молекуле сопряженных диенов π-электроны двойных связей взаимодействуют друг с другом (π, π-сопряжение), что приводит к изменению порядка и длины как простой σ-связи С-С, так и двойной связи С=С, увеличению стабильности молекулы.
Физические свойства.Бутадиены - бесцветные газообразные вещества с характерными запахами, изопрен - легкокипящая жидкость с приятным запахом. Диены по физическим свойствам близки к алкенам.
Химические свойства сопряженных диенов.Для сопряженных диенов известны все реакции, характерные для алкенов (присоединение, окисление, полимеризация). Наиболее характерным типом реакций являются реакции электрофильного присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация и др.), особенность которых состоит в том, что возможно образование продуктов 1,2- и 1,4-присоединения (по двойной связи и концам сопряженной цепи). Соотношение изомерных продуктов присоединения определяется температурным режимом, полярностью растворителя, характером реагента. Как правило, при низких температурах преобладают продукты 1,2-присоединения, при более высоких температурах и в полярных растворителях - 1,4-присоединения.
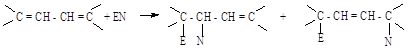 1,2-присоединение 1,4-присоединение
1,2-присоединение 1,4-присоединение
В реакциях электрофильного присоединения сопряженные диены более активны, чем алкены.
Полимеризацию (радикальную, ионную) сопряженных диенов осуществляют для синтеза синтетических каучуков. Синтетический каучук, по свойствам подобный натуральному, получают и координационной полимеризацией изопрена на катализаторах Циглера-Натта.
Сопряженным диенам свойственна реакция присоединения с образованием шестичленного цикла (реакция Дильса-Альдера, диеновый синтез):
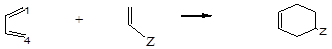
диен диенофил продукт 1,4-присоединения
Z: Н, -NO2, -C≡N, -COOH, -CHO и другие электроноакцепторные группы. Многие полученные соединения обладают высокой биологической активностью и широко используются как лекарственные препараты, средства защиты растений.
Знаете ли вы, что
-В 1861 году при нагревании природного каучука без доступа воздуха английским ученым К.Уильямсоном получен и назван первый диен - изопрен.
-Группа ученых под руководством Сергея Васильевича Лебедева - профессора Военно-медицинской академии г.Ленинграда в 1926 году впервые получила синтетический каучук.
-В 1928 году два немецких химика-органика Отто Пауль Дильс и Курт Альдер открыли реакцию циклоприсоединения к сопряженным диенам. В 1950 году за это открытие ученые удостоены Нобелевской премии.
-Каучук - сок дерева гевеи (от начала индийских слов: сао - дерево, chu -течь, плакать).
-В 1932 году началось мировое производство синтетического каучука, крупнейшие промышленные производители - Германия, США.
-Мировое производство каучуков приближается к 10 млн тонн в год. Из них изготавливают около 50 тыс. различных изделий.
-В 1939 году Ч. Гудьир при нагревании каучука с серой получил продукт, который в 1943 году Т. Гэнкок назвал резиной , а процесс - вудканизацией.
-Производные диенов - терпены широко представлены в природе, многие являются составной частью эфирных масел, придающих растениям специфический аромат (например, лимонен в кожуре цитрусовых).
Алкины
Алкины – углеводороды состава CnH2n-2, содержащие одну тройную углерод-углеродную связь.
Номенклатура. Названия алкинов образуют, заменяя суффикс «ан» в названии соответствующего алкана на суффикс «ин». Тривиальное название первого представителя гомологического ряда - ацетилен.
По рациональной номенклатуре алкинам дают названия как производным ацетилена, полученным в результате замещения одного или двух атомов водорода на алкильные радикалы. Например, пропин
СН3-С≡СН по рациональной номенклатуре будет иметь название - метилацетилен.
Нахождение алкинов в природе. Ацетилен и его гомологи мало распространены в природе. Более распространены полиины, которые обнаружены в некоторых растениях. В составе природных полиинов содержится от двух до пяти тройных углерод-углеродных связей.
Получение алкинов.В промышленных масштабах получают, в основном, ацетилен.
1. Пиролиз метана и алканов:
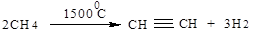
2. Гидролиз карбида кальция:
CaC2 + 2H2O → C2H2 + Ca(OH)2
3. Дегидрогалогенирование вицинальных и геминальных дигалогенидов:
отщепление галогеноводорода происходит под действием спиртового раствора щелочи:
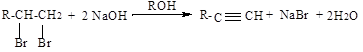
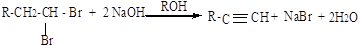
4. Алкилирование ацетилена и алкинов:
НС≡СNа + R-Сl → НС≡С-R + NаСl
R-С≡С- MgCl + R-Сl → R-С≡С-R + MgCl2
Изомерия.
Структурная
Для алкинов характерны следующие виды:
а) различное строение углеродной цепи (для углеводородов с числом атомов углерода ≥ 5);
б) различное расположение кратной связи (для углеводородов с числом атомов углерода ≥ 4;
в) межклассовая.
Межклассовыми изомерами алкинов могут быть алкадиены, циклоалкены.
Строение алкинов.Атомы углерода алкинов, образующие тройную связь, находятся в состоянии sр-гибридизации. Тройная связь представляет комбинацию σ-С-С (перекрывание sр - sр - орбиталей) и двух π-С-С связей (боковое перекрывание р-р-орбиталей). Молекула ацетилена имеет линейное строение, углы между связями соответствуют 1800, в молекулах гомологов и их изомеров присутствует только фрагмент линейной структуры.
Тройная связь, по сравнению с двойной, короче и более поляризуема. Увеличение электроотрицательности атома углерода в sр-гибридизации приводит к более высокой, по сравнению с алкенами, поляризации σ-С-Н-связи.
Молекула ацетилена неполярна, но при введении одной алкильной группы появляется значительный, по сравнению с этиленовыми углеводородами, дипольный момент:
δ+ δ-
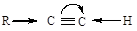
Физические свойства.Алкины представляют собой бесцветные газы или жидкости, начиная с С17 - твердые вещества. Поскольку для алкинов характерны значительные дипольные моменты, они, по сравнению с алканами и алкенами, имеют более высокие температуры кипения и плавления, относительную плотность. Алкины нерастворимы воде, однако хорошо растворяются в органических малополярных растворителях. Например, ацетилен хорошо растворяется в ацетоне.
Ацетилен термодинамически неустойчивое соединение, при сжижении легко разлагается на углерод и водород.
Химические свойства. Химические свойства алкинов определяются наличием С≡С-связи, для которой, как и для двойной углерод-углеродной связи, характерны реакции присоединения электрофильных и нуклеофильных реагентов, реакции окисления и полимеризации. Алкины с концевой тройной связью вступают в реакции замещения водорода при тройной связи, который обладает слабыми кислотными свойствами.
Таким образом, молекулы алкинов содержат два основных реакционных центра – С≡С-связь и подвижный водород:
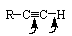
Реакции электрофильного присоединения. В реакциях электрофильного присоединения ацетилен и его гомологи по сравнению с алкенами проявляют меньшую реакционную способность, что обусловлено особенностями в строении тройной связи. Реакции протекают ступенчато (присоединение первой молекулы реагента, а затем - второй), при этом присоединение молекулы электрофила сопровождается образованием как одного геометрического изомера (стереоселективное присоединение), так и образованием смеси геометрических изомеров. Реакции присоединения к алкинам резко ускоряет присутствие в реакционной среде катализатора - соли меди (I) или ртути (II). Поэтому многие реакции присоединения к тройной связи рассматриваются как реакции нуклеофильного присоединения (вода, спирты, карбоновые кислоты и другие). В реакциях присоединения реакционная активность ацетилена по сравнению с другими алкинами мала.
а) присоединение галогенов:
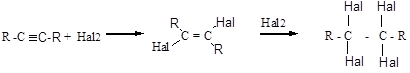
Взаимодействие с молекулой галогена происходит как стереоселективное транс-присоединение (образование транс-изомера). Реакция с бромом является качественной реакцией для обнаружения как двойной, так и тройной связи.
б) присоединение галогеноводородов:
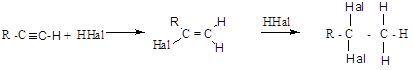
Присоединение галогеноводородов происходит по правилу Марковникова с образованием гем-дигалогенопроизводных.
Дата добавления: 2016-02-20; просмотров: 2128;
