НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
План
1. Алкены:
а) гомологический ряд, номенклатура, получение;
б) изомерия, строение;
в) свойства.
2. Алкадиены.
3. Алкины.
К непредельным (ненасыщенным) углеводородам относятся соединения, в составе которых присутствуют кратные углерод-углеродные связи: двойные С=С или тройные С≡ С (алкены, диены, алкины). Термин «непредельные» связан со способностью этих соединений вступать в реакции присоединения с разрывом кратных связей и с образованием соединений предельного (насыщенного) характера.
Алкены
Алкены (олефины) – это углеводороды состава СnH2n, содержащие в молекуле одну двойную связь С=С.
Гомологический ряд:
этен - СН2= СН2
пропен - СН3-СН=СН2
бутен-1 - СН3-СН2-СН=СН2
пентен-1 - СН3-СН2-Н2-СН=СН2 и т. д.
Номенклатура. Названия алкенов образуют от названий алканов, заменяя суффикс -ан на -ен.
Простейшие углеводороды имеют не систематические названия с суффиксом -илен: СН2= СН2 - этилен, СН3-СН=СН2 - пропилен.
Названия некоторых радикалов непредельных углеводородов:
СН2=СН - винил, СН2=СН-СН2 - аллил.
По рациональной номенклатуре алкенам дают названия как производным этилена, полученным в результате замещения одного или нескольких атомов водорода на алкильные радикалы. Например,
пропен СН2=СН-СН3 по рациональной номенклатуре будет иметь название - метилэтилен.
Нахождение в природе.Алкены в природе встречаются в составе нефтяного газа и горючих сланцев. Алкенами являются многие природные соединения растительного и животного происхождения, играющие важную биологическую роль. Например, в составе ненасыщенных и полиненасыщенных кислот растительных жиров, феромонов (половые аттрактанты, выделяемые насекомыми для привлечения особей противоположного пола).
Основные области применения алкенов указываются при рассмотрении свойств этих соединений.
Получение алкенов.
1. Крекинг алканов
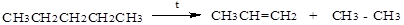
2. Дегидрирование алканов
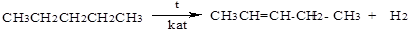
3. Дегидратация спиртов
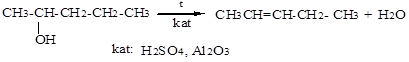
4. Дегидрогалогенирование галогеналканов
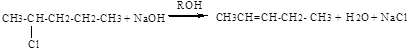
Дегидратация спиртов и дегидрогалогенирование галогеналканов протекают по правилу Зайцева.
5. Дегалогенирование вицинальных дигалогенидов
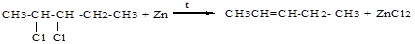
Изомерия.
1. Структурная(на примере углеводорода состава С5Н10):
а) различное строение углеродной цепи (для углеводородов с числом атомов углерода ≥ 4)
CH3-CH=CH-CH2-CH3 пентен-2 и
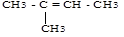
2-метилбутен-2
б) различное расположение кратной связи
CH2=CH-CH2-CH2-CH3 пентен-1
в) межклассовая
Алкены и циклоалканы с одинаковым числом атомов углерода являются
изомерами. Например, одним из изомеров будет циклопентан 
2. Геометрическая:
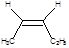
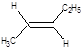
цис-пентен-2 транс-пентен-2
Взаимопревращения геометрических изомеров возможны только при высоких температурах или облучении УФ-светом. Подробно материал представлен в разделе «Изомерия».
Строение алкенов.Атомы углерода алкенов, образующие двойную связь, находятся в состоянии sр2-гибридизации. Двойная связь представляет комбинацию σ-С-С (перекрывание sр2-sр2 -орбиталей) и π- С-С связей (боковое перекрывание р-р-орбиталей). π-С-С связь, по сравнению с σ-связью, менее прочная, легко поляризуемая, более доступна для реагентов. Все σ-связи С-Н образованы в результате перекрывания sр2 -s или sр3-s -орбиталей.
Дипольный момент этилена равен нулю, поэтому соединение неполярно. У гомологов и изомеров углеводородные радикалы при двойной связи изменяют распределение электронной плотности в двойной связи, поэтому замещенные алкены имеют небольшой дипольный момент, их молекулы полярны. Например, пропен:
δ+ δ-
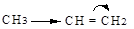
Молекула этилена имеет плоское тригональное строение, углы между связями соответствуют 1200, в молекулах гомологов и их изомеров находится только фрагмент плоской структуры.
Физические свойства.По физическим свойствам алкены мало отличаются от алканов. В гомологическом ряду физические свойства изменяются закономерно с ростом молекулярной массы. Различия в свойствах характерны как для структурных, так и пространственных изомеров.
Дата добавления: 2016-02-20; просмотров: 5352;
