Химические свойства. Химические свойства алкенов определяются наличием двойной углерод-углеродной связи
Химические свойства алкенов определяются наличием двойной углерод-углеродной связи. Поскольку π-связь обладает меньшей энергией, по сравнению с σ-связью, она легко разрывается под действием реагентов.
Для алкенов характерны реакции присоединения, окисления, полимеризации. π-связь оказывает влияние на реакционную способность связи С-Н в аллильном положении, что делает возможным протекание реакций радикального замещения атома водорода у α-углеродного атома.
1. Реакции электрофильного присоединения(АЕ)
AE реакции – основной тип превращений алкенов. Электрофильное присоединение происходит по ионному механизму. Реакция протекает в две стадии(Е-электрофил, N-нуклеофил):
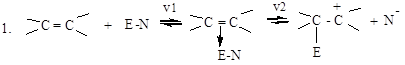

π-комплекс карбокатион

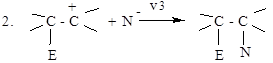
v1 - быстро, v2 - медленно, v3 — быстро.
На первой стадии электрофильный реагент образует π-комплекс с алкеном, в котором двойная связь выступает как донор, а электрофильный реагент как акцептор электронов. Далее π-комплекс медленно переходит в карбокатион (или σ-комплекс). На второй стадии происходит быстрое взаимодействие карбокатиона с нуклеофилом (N-) с образованием продукта реакции.
По электрофильному механизму к алкенам могут присоединяться галогены (Нalδ+ - Нalδ-), галогеноводороды (Нδ+ - Нalδ-), серная кислота ( Нδ+ - Оδ-SО3Н), вода (Нδ+ - Оδ- Н) и другие электрофильные реагенты (Нalδ+ - Оδ-Н ).
Электрофильное присоединение к несимметрично построенным алкенам протекает в соответствии с правилом Марковникова (русский химик Владимир Васильевич Марковников, 1869г): электрофил (протон Н+ или Е+) присоединяется к наиболее гидрированному атому углерода при двойной связи. Правило Марковникова не является универсальным. При введении в состав непредельных углеводородов электроноакцепторной группы (-NO2, -CF3, -CHO, -COOH, -CN и т.д.) присоединение происходит против правила Марковникова.
Региоселективное присоединение обусловлено поляризацией двойной связи в молекуле непредельного соединения и различием в устойчивости промежуточных карбокатионов.
Например:
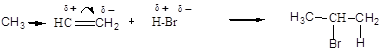
пропен 2-бромпропан
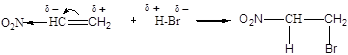
нитроэтилен 1-бром-2-нитроэтан
Карбокатион - промежуточный продукт реакции, очевидно, что реакция электрофильного присоединения протекает в направлении образования более стабильного карбокатиона. При этом электронодонорные группы (например, R - алкильные группы) повышают стабильность карбокатиона, электроноакцепторные (-NO2, -СCl3, - CCF3 ) - уменьшают. Поэтому стабильность карбокатионов в нижеуказанном ряду возрастает:
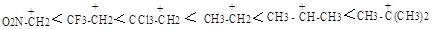
Поскольку электронодонорные группы повышают электронную плотность двойной связи, в этом же направлении (→) увеличивается и реакционная способность непредельных соединений:
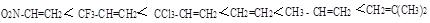
Таким образом, электрофильное присоединение несимметричных реагентов к несимметричным алкенам протекает в направлении образования наиболее стабильного карбокатиона.
В случае изменения механизма реакции, например в реакциях свободнорадикального типа (АR), присоединение протекает против правила Марковникова: присоединение НВr в присутствии перекиси водорода (эффект Хараша):
Н2 О2
СН3-СН=СН2 + НВr → СН3-СН-СН2
│ │
Н Вr
пропен 1-бромпропан
Присоединение галогеноводородов (гидрогалогенирование).Присоединение ННаl происходит по правилу Марковникова как в газовой среде, так и в растворах. Реакционная активность галогеноводородов увеличивается с повышением кислотности в ряду HF< HCl< HBr< HJ. В результате реакций образуются вторичные, третичные галогеналканы (первичные - в реакции только с этиленом).
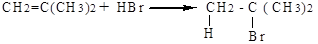
2-метилпропен 2-бром-2-метилпропан
Присоединение концентрированной серной кислотой.При взаимодействии алкеновс концентрированной серной кислотой образуются моноалкилсульфаты (сложные эфиры серной кислоты).
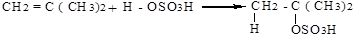
2-метилпропен трет-бутилсульфат
Алкилсульфаты при нагревании легко гидролизуются (разрушаются водой) с образованием спиртов:
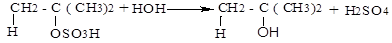
2-метилпропанол-2
Присоединение воды (гидратация).Алкены присоединяют воду в присутствии катализаторов (в гомогенных процессах катализаторы - минеральные кислоты, в гетерогенных - оксид алюминия, хлорид цинка и другие) с образованием спиртов. Присоединение происходит в соответствии с правилом Марковникова. Реакции гидратации лежат в основе промышленных способов получения из алкенов вторичных и третичных спиртов, из этилена получают первичный спирт - этанол.
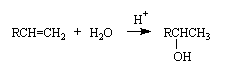
Присоединение галогенов (галогенирование).Галогены легко присоединяются к алкенам с образованием вицинальных дигалогенидов, например: R-CH=CH2 + Br-Br → R-CHBr-CH2Br .
Реакционная способность галогенов возрастает в ряду: I2 < Br2 < Cl2 < F2. Присоединение Br2 - качественная реакция на непредельные соединения. Фторирование и иодирование алкенов на практике не проводят.
Присоединение водорода (гидрирование).Присоединение водорода к алкенам с образованием предельных углеводородов происходит только в присутствии катализатора (металлический Ni, Pt, Pd и др.):
СН2=СН2 + Н2 → СН3 -СН3 + ΔН
Теплоты гидрирования дают возможность судить об устойчивости алкенов: чем больше выделяется тепла, тем устойчивее соединение. В ряду алкенов самым устойчивым является этилен.
2. Окисление алкенов.Алкены легко окисляются. В зависимости от окислителя и условий реакции образуются различные кислородсодержащие соединения.
Дата добавления: 2016-02-20; просмотров: 2815;
