Ацетиленовые углеводороды
| Название | Формула | Т пл., ºС | Т кип., ºС | Плотность, d, г/см3 |
| Ацетилен, [этин] Метилацетилен, [пропин] Этилацетилен, [бутин-1] Диметилацетилен, [бутин-2] Пропилацетилен, [пентин-1] Метилэтилацетилен, [пентин-2] | НС º СН СН3 – С º СН СН3 – СН2 – С º СН СН3 – С º С – СН3 СН3–СН2–СН2–СºСН СН3–СН2–СºС–СН3 | –80,8 – 104,7 – 122,5 – 28,0 – 98,0 – 101,0 | – 83,6 – 23,3 8,6 27,2 39,7 55,5 | 0,613 (– 80 ºС) 0,690 (– 40 ºС) 0,668 (0 ºС) 0,693 0,695 0,712 |
Видов изомерии алкинов только два: изомерия С-скелета и различное положение тройной связи в цепи. Из табл. 8 видно, что положение тройной связи существенно влияет на температуру кипения. До С15 алкины – жидкости, с С16 – твердые вещества.
5.2. Химические свойства алкинов
5.2.1. Электронное строение
Тройная (шестиэлектронная) связь в алкине образована по схеме на рис. 11. s-связи образованы перекрыванием sp-орбиталей, а две p-связи перекрыванием р-орбиталей, ориентированных вдоль параллельных осей (Y и Z, соответственно).
Молекула ацетилена имеет линейное строение (все четыре атома молекулы С2Н2 лежат на оси X).
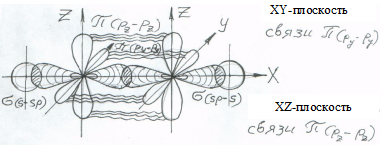
Рис. 11. Пространственное расположение орбиталей в молекуле ацетилена и схема образования связей (p-связи показаны волнистой чертой, s-связи заштрихованы)
Алкины способны вступать в реакции присоединения, окисления, полимеризации и замещения.
5.2.2. Реакции присоединения
Как сильно ненасыщенные, алкины легко присоединяют водород, галогены и молекулы типа НХ (последние с соблюдением правила Марковникова).
1. Реакции присоединения протекают ступенчато: с присоединением каждой пары атомов кратность связи уменьшается на единицу.
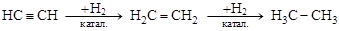
[этин] [этен] [этан]
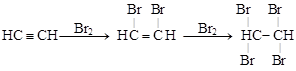
[этин] [1,2-дибромэтен] [1,1,2,2-тетрабромэтан]
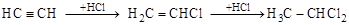
[этин] [хлорэтен] [1,1-дихлорэтан]
(хлорвинил)
2. Гидратация ацетиленовых (реакция Кучерова 1881 г.) идет в присутствии солей Hg+2:
|


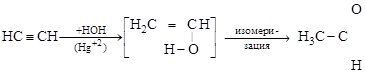
виниловый спирт ацетальдегид
Гидратация гомологов ацетилена дает кетоны:

|
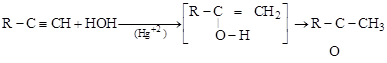
алкин енол кетон
|
Дата добавления: 2016-04-14; просмотров: 1155;
