Промышленные способы получения водорода.
Федеральное агентство по образованию
Государственное образовательное учреждение
Высшего профессионального образования
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова
Кафедра общей химической технологии
Чабан Н.Г.
Основные химические производства.
( для студентов V курса факультета “ Мененджмент, экология и экономика” по направлению № 060800 “Экономика и организация производства”)
Учебное пособие.
УДК 66,0
Основные производства.
Учебное пособие. Чабан Н.Г. –М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2008.- 25 с.
Учебное пособие предназначено для студентов V курса дневного отделения факультета “Мененджмент, экология и экономика” по специальньности № 060800 “Экономика и организация производства”. В пособие представлены основные химические производства. Химизм процессов, оптимальные условия их проведения, технологические схемы, конструкции основных аппаратов.
Рекомендовано Библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве учебно-методического пособия.
Глава 1.
Производство водорода.
Области применения: в производстве аммиака, метанола, соляной кислоты, в металлургии, используется при гидрокрекинге и гидроочистке нефтепродуктов и т.д.
Промышленные способы получения водорода.
1). Физический – извлечение водорода из коксового газа методом глубокого охлаждения фракционно-термическая конденсация).
2). Электрохимический метод – электролиз воды. Чистота получаемого водорода – 99,8%. Недостаток метода – большой расход электроэнергии.
3). Химический метод – конверсия углеводородных газов. В качестве исходного сырья применяются: углеводородный газ –метан или углеводороды бензиновой фракции нефти.
Конверсия метана – это окисление метана при высокой температуре кислородом или кислородосодержащими соединениями: Н2О или СО2.
По используемому окислителю и технологическому оформлению можно выделить следующие варианты процесса получения водорода: каталитическая парокислородная конверсия, высокотемпературная кислородная конверсия, каталитическая пароуглекислотная конверсия.
Окисление метана при получении синтез-газа протекает по следующим основным суммарным реакциям:
СН4 + Н2О 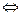 СО +3Н2 -Q (1.1.)
СО +3Н2 -Q (1.1.)
СН4 + 0,5О2 = СО + 2Н2 + Q (1.2.)
СН4 + СО2 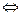 2СО + 2Н2 -Q (1.3.)
2СО + 2Н2 -Q (1.3.)
В реальных условиях ведения процесса реакции 1.1. и 1.3. являются обратимыми и эндотермическими, реакция 1.2. – необратимая и экзотермическая.
Первая ступень конверсии метана.
СН4 + Н2О 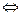 СО + 3Н2 - Q (1.1.)
СО + 3Н2 - Q (1.1.)
Помимо основной реакции возможно протекание побочной реакции разложения метана при температуре около 9500С:
СН4 = С + 2Н2 (1.4.)
Реакция (1.1.) в газовой фазе идет медленно (Е=62,2 кКал/моль). Для ее ускорения процесс проводят гетерогенно на поверхности твердого никелевого катализатора. Никель напыляет ся на твердый носитель Al2O3 или MgO. Катализатор изготавливается в виде гранул, таблеток или колец и состоит из пористого носителя и активного компонента. Наличие катализатора позволяет не только увеличить скорость основной реакции, но и при соответствующем избытке окислителей исключить протекание побочной реакции.
Срок службы катализаторов конверсии при правильной эксплуатации достигает трех лет и более. Их активность снижается при действии различных каталитических ядов. Никелевые катализаторы наиболее чувствительны к действию сернистых соединений. Отравление происходит вследствие образования на поверхности катализатора сульфидов никеля, совершенно неактивных по отношению к реакции конверсии метана. Отравленный серой катализатор удается почти полностью регенерировать в определенных температурных условиях при подаче в реактор чистого газа. Активность зауглероженного катализатора можно восстановить, обрабатывая его водяным паром. Поэтому перед конвектором метана газ подвергают сероочистке.
Никелевый катализатор работает в широком температурном интервале 600-10000С.
Выбор температуры.
С увеличением температуры увеличивается выход, но чем выше температура, тем больше затраты электроэнергии, выше требования к термической устойчивости материалов, и, соответственно, становится более дорогой аппаратура.
Так как часть метана конвертируется во второй ступени воздухом, реакцию (1.1.) не нужно доводить до конца. Поэтому оптимальная температура процесса определяется не условиями равновесия, а кинетикой реакции.
Кроме того, следует отметить, что при температуре 9500С начинает интенсивно проходить побочная реакция разложения метана с образованием сажи. Теряется активность катализатора.
Поэтому, наиболее оптимальной температурой проведения первой стадии конверсии метана является 8000С. В первой стадии конвертируется около 90% метана.
Выбор давления.
Для смещения равновесия в сторону образования продуктов необходимо давление снижать, так как процесс идет с увеличением числа молей. Однако, на практике процесс конверсии метана проводят при давлении 4 МПа. Отрицательное действие давления на выход компенсируют повышенной температурой и избытком водяного пара.
Преимущества повышенного давления:
1). Поскольку последующие процессы, в которых используют водород, ( производство аммиака и метанола) протекают при высоком давлении (30 МПа), то повышение давления при конверсии метана в целом позволяет снизить затраты на компримирование.
2). При повышенном давлении увеличивается скорость реакции, растет производительность.
3). Снижаются капитальные затраты на строительство водородной установки ( уменьшается объем водородной установки, объем трубопроводов, число компрессоров). Используется магистральное давление трубопроводов.
4). При повышенном давлении улучшается возможность использования скрытой теплоты водяного пара.
5). Улучшается очистка от СО2.
Выбор соотношения исходных компонентов.
Процесс конверсии метана проводят с избытком водяного пара. Избыток водяного пара выбирают с таким расчетом, чтобы скомпенсировать высокое давление, а также необходимостью его для последующего процесса конверсии СО.
Н2О/СН4 = (2-4)/1
Дата добавления: 2016-03-27; просмотров: 1166;
