Внутренняя энергия. 3 страница
Еще одна особенность теплоты наиболее ярко раскрывается при рассмотрении процесса преобразования ее в работу. Опыт показывает, что работа может быть полностью превращена в теплоту (например, посредством трения) без каких-либо дополнительных условий или компенсации. Обратное же превращение теплоты в работу требует дополнительного самопроизвольного процесса или компенсации.
Второй закон термодинамики устанавливает направленность и условия протекания естественных процессов. Так же, как и первый закон термодинамики, он был выведен на основании экспериментальных данных.
Опыт показывает, что превращение теплоты в полезную работу в тепловых двигателях может происходить только при переходе теплоты от нагретого тела к холодному, то есть при наличии разности температур между теплоотдатчиком (нагревателем) и теплоприемником (холодильником). При этом вся теплота не может быть превращена в работу.
Устройство, которое без компенсации полностью превращало бы в работу теплоту какого-либо источника, называется вечным двигателем второго рода.
Таким образом, второй закон термодинамики утверждает, что создание вечного двигателя второго рода невозможно.
Открытие второго закона термодинамики связано с анализом работы тепловых машин. Впервые сущность этого закона изложил в 1824 г. французский инженер С. Карно в работе «Размышление о движущей силе огня и машин, способных развивать эти силы». С. Карно впервые указал на возможность превращения теплоты в полезную работу в двигателях лишь при наличии двух источников теплоты: одного с более высокой температурой (нагреватель с температурой T2) и другого с меньшей температурой (холодильник с температурой T1).
Позднее Р. Клаузиус и В. Томсон (Кельвин) дали наиболее общие формулировки второго закона термодинамики, из которых следует, что:
1. Невозможен процесс, при котором теплота переходила бы самопроизвольно от холодных тел к телам нагретым.
2. Не вся теплота, полученная от теплоотдатчика, может перейти в работу, а только часть ее. Часть теплоты должна перейти в теплоприемник.
5.2.Обратимые и необратимые процессы
В изолированной термодинамической системе через некоторый промежуток времени устанавливается внутреннее равновесие, при котором рабочее тело по всей массе имеет одинаковую температуру и давление.
При равенстве давлений в системе и в окружающей среде изменение объема рабочего тела прекращается, и передача энергии в форме работы отсутствует (система находится в механическом равновесии со средой). Равенство температур рабочего тела и среды обеспечивает термическое равновесие. При этом между системой и окружающей средой не возникает передачи энергии в форме теплоты. Термодинамический процесс возможен только при нарушении механического или термического равновесия, и чем сильнее нарушается равновесие, тем быстрее протекает процесс. Все реальные термодинамические системы не изолированы от окружающей среды, которая выводит их из равновесия. Поэтому они являются неравновесными. Учитывая чрезвычайную сложность теплотехнических расчетов таких процессов, на практике их заменяют равновесными, то есть такими, при которых система проходит последовательно бесчисленное множество равновесных состояний. Эти равновесные процессы называют квазистатическими.
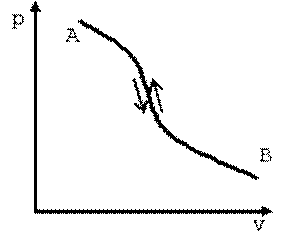
|
| Рис. 5.1. Линии обратимых прямого A-B и обратного B-A процессов на pv-диаграмме |
Для любой термодинамической системы можно представить два состояния, между которыми будет проходить два процесса: один от первого состояния ко второму и другой, наоборот, от второго состояния к первому. Первый процесс называют прямым, второй — обратным. Если после прямого процесса 1—2 следует обратный 2—1 и при этом термодинамическая система возвращается в исходное состояние, то такие процессы принято считать обратимыми. При обратимых процессах система в обратном процессе проходит через те же равновесные состояния, что и в прямом процессе. При этом ни в окружающей среде, ни в самой системе не возникает никаких остаточных явлений, то есть не имеет значения идет процесс А-В или В-А (рис. 5.1).
Различают механически и термически обратимые процессы.
В механически обратимом процессе обмен энергией между системой и окружающей средой протекает в форме работы при бесконечно малой разности давлений.
В термически обратимом процессе термодинамическая система обменивается с окружающей средой энергией в форме теплоты при бесконечно малой разности температур.
Любой равновесный термодинамический процесс изменения состояния рабочего тела будет всегда обратимым. Обратимые процессы являются идеальными.
Действительные термодинамические процессы совершаются при конечной разности давлений и температур рабочего тела и окружающей среды и поэтому являются неравновесными. Такие процессы необратимы.
Необратимый термодинамический процесс – это процесс, при котором система не возвращается в исходное состояние после обратного процесса. Все необратимые процессы протекают в направлении достижения в термодинамической системе равновесия, то есть выравнивания в ней давлений, температур, концентраций.
5.3.Круговые термодинамические процессы или циклы
При однократном расширении рабочего тела можно получить ограниченное количество работы. Поэтому разомкнутый процесс непригоден для непрерывного превращения теплоты в работу. Для повторного получения работы необходимо возвратить рабочее тело в исходное состояние, то есть сжать рабочее тело. На сжатие рабочего тела должна быть затрачена работа. Эта работа подводится от какого-либо внешнего источника. Причём процесс сжатия рабочего тела должен осуществляться по пути, отличному от пути процесса расширения. В противном случае суммарная работа, полученная в результате кругового процесса, будет равна нулю. Поэтому путь процесса сжатия выбирается таким, чтобы работа сжатия по абсолютной величине была меньше работы расширения. На рис. 5.2 приведен круговой процесс, в котором рабочее тело расширяется по кривой 1-3-2. При этом работа расширения численно равна площади 132451. Процесс возвращения рабочего тела из конечного состояния 2 в начальное состояние 1 может осуществляться одним из следующих путей:
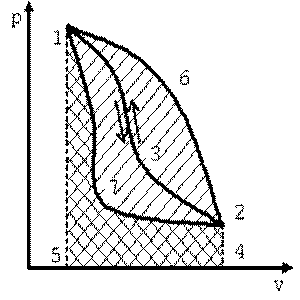
|
| Рис. 5.2. К выбору кругового процесса |
1. По кривой сжатия 2-3-1. При этом работа сжатия (площадь 231542) будет равна работе расширения (площадь 132451). В результате суммарная работа в таком круговом процессе равна нулю.
2. По кривой сжатия 2-6-1, расположенной над кривой расширения 1-3-2. При этом работа сжатия (площадь 261542) больше работы расширения (площадь 132451). Суммарная работа в таком круговом цикле будет отрицательной.
3. По кривой сжатия 2-7-1, расположенной ниже кривой расширения. В этом круговом процессе работа расширения (площадь 132451) больше работы сжатия (площадь 271542), а площадь, ограниченная замкнутой кривой 1-3-2-7-1, представляет собой работу цикла. Следовательно, чтобы работа была положительной, нужно, чтобы кривая сжатия 2-7-1 в pv-диаграмме была расположена ниже кривой расширения 1-3-2. Многократно повторяя такой круговой процесс, можно за счёт подвода теплоты получить любое количество работы.
Циклы, в которых теплота превращается в положительную работу, называются прямыми. Такие циклы в pv-диаграмме протекают по часовой стрелке. По прямым циклам работают тепловые двигатели.
Цикл, в котором получается отрицательная работа, называется обратным. В нём работа сжатия больше работы расширения. По обратным циклам работают холодильные машины.
Циклы могут быть обратимыми и необратимыми. Обратимым термодинамическим циклом называется цикл, все процессы которого обратимы. Необратимым термодинамическим циклом называется цикл, в котором хотя бы один из составляющих его процессов необратим.
5.4.Термический коэффициент полезного действия
Степень совершенства преобразования теплоты в механическую работу в термодинамическом цикле оценивается термическим коэффициентом полезного действия (к.п.д.). Термическим к. п. д. термодинамического цикла называется отношение работы, совершенной в прямом обратимом термодинамическом цикле, к теплоте, сообщенной рабочему телу от внешних источников:
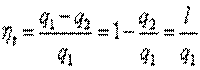 , ,
| (5.1) |
где q1 – тепло отданное в цикле рабочему телу теплоотдатчиком; q2 – тепло отданное в цикле рабочим телом теплоприёмнику; q1-q2 – тепло, преобразованное в цикле в механическую работу l.
Термический к. п. д. термодинамического цикла показывает, какое количество получаемой теплоты машина превращает в работу в конкретных условиях протекания идеального цикла. Чем больше величина ηt, тем совершеннее цикл и тепловая машина. Значение термического к. п. д. термодинамического цикла всегда меньше единицы.
5.5.Аналитическое выражение второго закона термодинамики
5.5.1.Цикл Карно
В 1824 г. С.Карно впервые рассмотрел обратимый термодинамический цикл, состоящий из двух изотерм и двух адиабат. Этот цикл представляет собой замкнутый процесс, совершаемый рабочим телом в идеальной тепловой машине при наличии двух истопников теплоты: нагревателя (горячего источника) с температурой T1 и холодильника (холодного источника) с температурой T2 Цикл Карно в pv-диаграмме изображен на рис. 5.3.
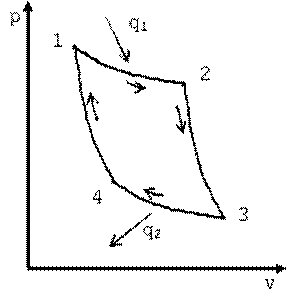
|
| Рис. 5.3. Прямой цикл Карно |
Процессы 1—2 и 3—4 являются изотермическими, а 2—3 и 4—1 — адиабатными. Начальная температура рабочего тела в цикле принимается равной температуре нагревателя T1. При изотермическом расширении от состояния 1 до состояния 2 рабочее тело получает от нагревателя количество теплоты q1 при температуре T1. На участке 2—3 рабочее тело адиабатно расширяется. При этом температура рабочего тела понижается от T1 до T2, а давление падает от p2 до p3. При сжатии по изотерме 3—4 от рабочего тела отводится к холодильнику количество теплоты q2 при температуре T2. Дальнейшее сжатие по адиабате 4—1 приводит к повышению температуры рабочего тела от T2 до T1, а рабочее тело возвращается в первоначальное состояние.
Суммарная работа цикла lц графически изображается площадью 12341.
Термический к. п. д. цикла
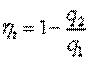 . .
| (5.2) |
Количество теплоты q1 и q2 определим из уравнений

|
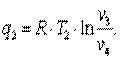
|
Подставляя полученные значения q1 и q2 в уравнение (5.2), находим
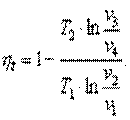
| (5.3) |
Покажем, что

| (5.4) |
Для адиабатных процессов расширения 2—3 и сжатия 4—1 соответственно имеем
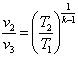
| и | 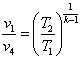 , ,
|
откуда
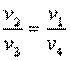
| или | 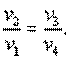
|
С учетом соотношения (5.4) уравнение (5.3) принимает вид
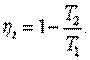
| (5.5) |
Из уравнения (5.5) следует:
1. Термический к. п. д. цикла Карно зависит только от абсолютных температур нагревателя T1 и холодильника T2. Он возрастает с увеличением температуры T1 и уменьшением T2, то есть чем больше разность температур T1—T2, тем выше к. п. д. цикла Карно.
2. Термический к. п. д. цикла Карно всегда меньше единицы. Равенство ηt=1 возможно только при T2=О или T1=∞, что практически невозможно реализовать.
Теплота q1, подводимая к рабочему телу в цикле Карно, не может быть полностью превращена в работу, значительное количество теплоты отводится к теплоприемнику.
3. Термический к. п. д. цикла Карно при T1=T2 равен нулю, таким образом, невозможно превращение теплоты в работу, если все тела системы имеют одинаковую температуру, то есть находятся между собой в тепловом равновесии.
4. Термический к. п. д. цикла Карно не зависит от устройства двигателя и физических свойств рабочего тела, а зависит лишь от температур нагревателя T1 и холодильника T2. Это положение известно под названием теоремы Карно. Последнее следует из того, что формула (5.5) не содержит величин, характеризующих свойства рабочего тела.
5.5.2.Соотношения, связанные с циклом Карно
Для обратимого цикла Карно имеем
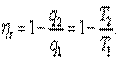
|
Откуда
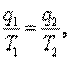
| или | 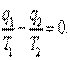
|
Учитывая, что теплота q1 положительна, а теплота q2 отрицательна, запишем
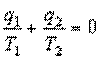
|
или
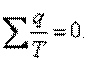
| (5.6) |
Отношение 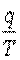 называется приведенной теплотой.
называется приведенной теплотой.
Из уравнения (5.6) следует, что в обратимом цикле Карно алгебраическая сумма приведенных теплот равна нулю.
Нетрудно показать, что равенство (5.6) справедливо не только для цикла Карно, но и для любого обратимого цикла. С этой целью рассмотрим в pv-диаграмме произвольный обратимый цикл (рис. 5.4).

|
| Рис. 5.4. Представление произвольного обратимого кругового процесса в виде суммы бесконечно малых циклов Карно |
Проведем большое количество близко расположенных адиабат, которые разобьют произвольный цикл на бесконечно большое количество элементарных циклов efgh, fmng и т. д. Каждый такой элементарный цикл состоит из двух адиабат и двух элементарных отрезков контура данного цикла. Ввиду бесконечно малой длины этих отрезков изменения температуры по ним так же бесконечно малы. Следовательно, в пределе эти отрезки можно считать изотермами, а циклы — элементарными циклами Карно. Совокупное действие элементарных циклов одинаково с действием кругового цикла ABCD.
Работа расширения по адиабате fg цикла efgh равна работе сжатия по адиабате gf цикла fmng. Таким образом, адиабатные процессы, в конечном счете, не влияют на величину работы, теплота же во время этих процессов не подводится и не отводится. Суммарное действие элементарных циклов сводится к совокупному действию элементарных процессов ef, fm, ng, gh и т. д., то есть одинаково с действием кругового процесса по контуру ABCD.
Для каждого элементарного цикла Карно справедливо соотношение (5.6). Суммируя эти соотношения для всех элементарных циклов, для рассматриваемого произвольного цикла получим
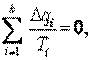
| (5.7) |
где k – количество элементарных циклов.
В пределе для бесконечно большого числа этих элементарных циклов, то есть для цикла ABCD получим
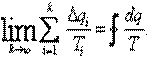
|
С учетом (5.7) имеем
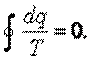
| (5.8) |
Известно, если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение представляет собой полный дифференциал некоторой функции состояния. В термодинамике отношение dq/T принято считать полным дифференциалом функции состояния s, называемой энтропией, то есть
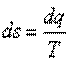
|
или
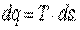
| (5.9) |
Уравнение (5.8), полученное Клаузиусом в 1834 г., представляет собой математическое выражение второго закона термодинамики для обратимого цикла и называется первым интегралом Клаузиуса.
Термический к. п. д. необратимого цикла меньше, чем термический к. п. д. цикла Карно из-за потерь части подведенного к рабочему телу тепла в окружающую среду. Таким образом
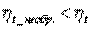
| и | 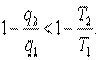
|
Отсюда
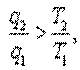
|
или
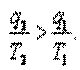
| (5.10) |
Учитывая, что теплота q2 — величина отрицательная, неравенство (5.10) можно представить в виде
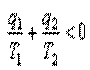
|
или
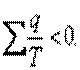
| (5.11) |
Неравенство (5.11) показывает, что алгебраическая сумма приведенных теплот для необратимого цикла Карно меньше нуля, то есть является величиной отрицательной.
Для произвольного необратимого цикла, составленного из бесконечно большого количества необратимых элементарных циклов, имеем
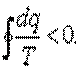
| (5.12) |
Неравенство (5.12) представляет собой математическое выражение второго закона термодинамики для произвольного необратимого цикла и называется вторым интегралом Клаузиуса.
5.6.Изменение энтропии в обратимых и необратимых процессах
Рассмотрим изменение энтропии в обратимых термодинамических процессах. Для таких процессов 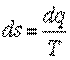 . Отсюда следует, что в обратимых процессах энтропия может как возрастать, так и убывать. Температура является положительной величиной. Поэтому при подводе теплоты к системе (dq>0) отношение dq/T, равное ds, будет больше нуля. Следовательно, в этом случае энтропия системы возрастает. Если же теплота отводится от системы (dq<0), то ds<0 и энтропия убывает.
. Отсюда следует, что в обратимых процессах энтропия может как возрастать, так и убывать. Температура является положительной величиной. Поэтому при подводе теплоты к системе (dq>0) отношение dq/T, равное ds, будет больше нуля. Следовательно, в этом случае энтропия системы возрастает. Если же теплота отводится от системы (dq<0), то ds<0 и энтропия убывает.
Интегрируя уравнение для ds в пределах от начального состояния 1 до конечного 2, найдем, что энтропия рабочего тела изменится на величину
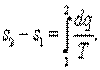
| (5.13) |
В обратимом адиабатном процессе dq=0. Поэтому из (5.13) имеем s2—s1=0 и s2=s1, то есть в обратимом адиабатном процессе энтропия постоянна (s=const).
Рассмотрим теперь, как изменяется энтропия в необратимых процессах. Пусть какой-либо произвольный цикл состоит из двух процессов: необратимого 1—а—2 и обратимого 2—b—1 (рис. 5.5). Такой цикл является необратимым. Выражение (5.12) для него будет иметь вид
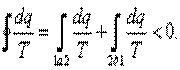
| (5.14) |
Для обратимого процесса 2—b—1, согласно (5.13), имеем
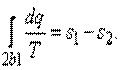
| (5.15) |
Тогда выражение (5.14) запишется в виде
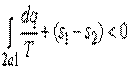
| (5.16) |
или
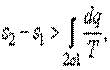
|
то есть в необратимом процессе значение интеграла меньше, чем изменение энтропии в конечном и начальном состояниях.
В дифференциальной форме выражение (5.16) имеет вид
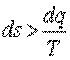 , ,
|

|
| Рис. 5.5. Необратимый цикл, который состоит из необратимого 1-a-2 и обратимого 2-b-1 циклов |
или
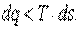
| (5.17) |
Так же, как и (5.12), формула (5.17) представляет собой уравнение второго закона термодинамики для необратимых процессов. В общем случае для обратимых и необратимых процессов с учетом уравнений (5.8), (5.12) и (5.9), (5.17) можно записать

| (5.18) |
и 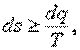 (5.19)
(5.19)
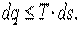 (5.20)
(5.20)
В приведенных выражениях знак равенства относится к обратимым, а знак неравенства — к необратимым процессам.
Тема 6.ВОДЯНОЙ ПАР
6.1.Основные понятия и определения
Известно, что любое вещество в зависимости от внешних условий (давления и температуры) может находиться в газообразном, жидком и твердом агрегатных состояниях, или фазах, а также одновременно находиться в двух или трех состояниях.
Переход вещества из одного агрегатного состояния в другое называется фазовым переходом, или фазовым превращением. Вещество в разных агрегатных состояниях имеет различные свойства, в частности плотность. Это различие объясняется характером межмолекулярного взаимодействия.
Переход вещества из твердого состояния в жидкое называется плавлением, из жидкого в газообразное — испарением, из твердого в газообразное — сублимацией. Обратные процессы соответственно называются затвердеванием, или кристаллизацией, конденсацией и де-сублимацией.
Процесс получения пара из жидкости может осуществляться испарением и кипением. Испарением называется парообразование, происходящее только со свободной поверхности жидкости и при любой температуре.
Кипением называется бурное парообразование по всей массе жидкости, которое происходит при сообщении жидкости через стенку сосуда определенного количества теплоты. При этом образовавшиеся у стенок сосуда и внутри жидкости пузырьки пара, увеличиваясь в объеме, поднимаются на поверхность жидкости.
Процесс парообразования начинается при достижении жидкостью температуры кипения, которая называется температурой насыщения tн и на протяжении всего процесса остается неизменной. Температура кипения, или температура насыщения, tн зависит от природы вещества и давления, причем с повышением давления tн увеличивается. Давление, соответствующее tн называется давлением насыщения рн.
Насыщенным паром называют пар, который образовался в процессе кипения и находится в динамическом равновесии с жидкостью. Насыщенный пар по своему состоянию бывает сухим насыщенным и влажным насыщенным.
Сухой насыщенный пар представляет собой пар, не содержащий капель жидкости и имеющий температуру насыщения (t=tн) при данном давлении.
Влажный насыщенный пар – это равновесная смесь, состоящая из капель жидкости, находящейся при температуре кипения, и сухого насыщенного пара.
Отношение массы сухого насыщенного пара mс.п. к массе влажного насыщенного пара mв.п. называется степенью сухости х влажного пара, то есть
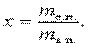
|
Очевидно, что для жидкости х=0, для сухого насыщенного пара х=1.
Если к сухому насыщенному пару продолжать подводить теплоту, то его температура увеличится. Пар, температура которого при данном давлении больше, чем температура насыщения (t>tн), называется перегретым. Другими словами говоря перегретый пар – это пар, находящийся при температуре, превышающей температуру кипения жидкости при давлении, равном давлению перегретого пара. Величина превышения температурой пара температуры кипения жидкости называется степенью перегрева пара.
Водяной пар является реальным рабочим телом и может находиться в трёх состояниях: влажного насыщения, сухого насыщения и в перегретом состоянии. Для технических нужд водяной пар получают в паровых котлах (парогенераторах), где специально поддерживается постоянное давление.
6.2.Схема парогенератора
Котельная установка (парогенератор) служит для получения пара в широком диапазоне параметров и состоит из котельного агрегата и вспомогательного оборудования, связанных единой технологической схемой. К вспомогательному оборудованию относятся устройства топливо подачи, дымососы, золоуловители, паропроводы, водопроводы и др.
Схема котельного агрегата представлена на рис. 6.1.
Котельный агрегат П-образной компоновки состоит из подъёмного 1 и опускного газоходов. Подъёмный газоход 2 представляет собой топку для сжигания топлива, на стенках которой установлены испарительные поверхности нагрева 3 в виде плоских трубчатых панелей, называемых экранами.
В опускном газоходе расположены водяной экономайзер 4 для подогрева питательной воды и воздухоподогреватель 5 для подогрева воздуха, идущего на горение в топку. На выходе из подъёмного газохода расположен фестон 6, представляющий собой разреженный пучок труб - продолжение заднего экрана.
Дата добавления: 2016-03-27; просмотров: 1222;
