ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ И ЗАКОНЫ
1.1Предмет и метод технической термодинамики
Исторически термодинамика возникла как наука, изучающая переход теплоты в механическую работу, что диктовалось необходимостью дать теоретические основы работы тепловых (паровых) машин.
В основу термодинамики положены три экспериментальных закона и уравнение состояния: первый закон (первое начало термодинамики) - закон сохранения и превращения энергии; второй закон (второе начало термодинамики) указывает направление процесса, по которому протекают все естественные явления в природе; третий закон (третье начало термодинамики) утверждает, что абсолютный нуль температуры недостижим.
1.2 Термодинамическая система
Термодинамическая система — тело (совокупность тел), способное (способных) обмениваться с другими телами или между собой энергией и веществом.
Термодинамическая система имеет границы, отделяющие ее от окружающей среды. Границы термодинамической системы могут быть как реальными (газ в резервуаре, граница раздела фаз), так и чисто условными в виде контрольной поверхности.
Термодинамическая система может энергетически взаимодействовать с окружающей средой и с другими системами, а также обмениваться с ними веществом. В зависимости от условий взаимодействия с другими системами различают изолированную, замкнутую, открытую и адиабатно изолированную термодинамические системы.
Термодинамическая система, которая не может обмениваться энергией и веществом с другими системами, называется изолированной. В такой системе отдельные части (подсистемы) могут взаимодействовать между собой. Термодинамическая система называется закрытой, если она не может обмениваться веществом с другими системами. Термодинамические системы, которые могут обмениваться веществом с другими системами, называются открытыми.
Термодинамическая система, которая не может обмениваться теплотой с другими системами (окружающей средой), называется теплоизолированной или адиабатно изолированной.
С окружающей средой термодинамическая система может энергетически взаимодействовать посредством передачи теплоты и производства работы.
По роли отдельных тел, входящих в термодинамическую систему, их делят на рабочие тела (РТ), источники теплоты (ИТ) и объекты работы (ОР).
Рабочими телами являются, как правило, газообразные вещества - газы и пары, которые способны значительно изменять свой объём при изменении внешних условий.
В тех состояниях, когда можно пренебречь влиянием сил взаимодействия между молекулами и объёмом самих молекул (сильно нагретый газ при небольших давлениях), газ называют идеальным. В противном случае газ называется реальным.
Рабочее тело в тепловой машине получает или отдаёт теплоту, взаимодействуя с более нагретыми или более холодными внешними телами. Такие тела носят название источников теплоты.
Тело, которое отдаёт теплоту рабочему телу и не изменяет свою температуру, называется верхним источником теплоты (ВИТ) или теплоотдатчиком. Тело, которое получает теплоту от рабочего тела и не изменяет свою температуру, называется нижним источником теплоты (НИТ) или теплоприёмником.
1.3 Термодинамическое состояние и термодинамический процесс
Совокупность физических свойств системы в рассматриваемых условиях называют термодинамическим состоянием системы.
Различают равновесное (стационарное) и неравновесное (нестационарное) состояния термодинамической системы.
Макроскопические величины (т. е. величины, которые характеризуют тело в целом), характеризующие физические свойства тела в данный момент, называются термодинамическими параметрами состояния. Последние разделяются на интенсивные (не зависящие от массы тела) и на экстенсивные (пропорциональные массе тела).
Равновесным состоянием термодинамической системы называется такое состояние, которое характеризуется при постоянных внешних условиях неизменностью параметров во времени и отсутствием в системе потоков. Состояние термодинамической системы, при котором во всех ее частях температура одинакова, называют термическим равновесным состоянием.
Изолированная термодинамическая система независимо от своего начального состояния с течением времени всегда приходит в состояние равновесия. При этом отметим, что никогда самопроизвольно выйти из него т/д система не может (основной постулат термодинамики — нулевое начало).
Состояние термодинамической системы, при котором значения параметров во всех частях ее остаются неизменными во времени благодаря внешнему воздействию потоков вещества, энергии, импульса, заряда и т. п., называется стационарным. Если значения параметров изменяются во времени, то состояние термодинамической системы называется нестационарным.
Любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее параметров, называется термодинамическим процессом. Если одна система совершает работу над другой системой с помощью механических и иных физических сил, то такое взаимодействие называется механическим. Взаимодействие, которое приводит к изменению энергии и совершается в форме передачи теплоты посредством теплопроводности или тепловой радиации, называется тепловым. Взаимодействие, приводящее к изменению энергии и совершаемое в форме передачи массы, называется массообменным.
Различают равновесные и неравновесные процессы.
Равновесным процессом называется термодинамический процесс, представляющий собой непрерывную последовательность равновесных состояний. В таком процессе физические параметры изменяются бесконечно медленно, так что система все время находится в равновесном состоянии. Кроме того, все части системы имеют одинаковые температуру и давление.
Неравновесным процессом называется термодинамический процесс, представляющий собой последовательность состояний, среди которых не все являются равновесными. В неравновесном процессе различные части системы имеют разные температуры, давления, плотности, концентрации.
Если термодинамическая система выведена из состояния равновесия и предоставлена сама себе, то через некоторый промежуток времени она снова придет в состояние равновесия. Процесс перехода системы из неравновесного состояния в равновесное называется релаксацией, а время перехода в состояние равновесия — временем релаксации.
1.4 Термические и калорические параметры состояния
К основным термическим параметрам состояния, поддающимся непосредственному измерению простыми техническими средствами, относятся абсолютное давление p, удельный объём v и абсолютная температураT.
К параметрам, характеризующим состояния термодинамической системы, также относятся: внутренняя энергия U, энтальпия H и энтропия s, которые носят название калорических параметров состояния.
1.4.1 Термические параметры состояния
Давление — физическая величина, численно равная отношению нормальной составляющей силы к площади, на которую действует эта сила.
Единицей давления в СИ является паскаль — давление, вызываемое силой в 1 Н, равномерно распределенной по поверхности площадью 1 м2 (1Па=1 Н/м2). Часто приходится измерять давление высотой столба какой-либо жидкости (воды, ртути и пр.).
В табл. 1.1 приведены соотношения между единицами измерения давления и единицами давления в СИ.
Таблица 1.1 Соотношения между единицами измерения давления
| Единица | Па | бар | кгс/см2 | мм рт.ст. | мм вод.ст. | |
| 1 Па | 10-5 | 1,02·10-5 | 7,5024·10-3 | 1,02·10-1 | ||
| 1 бар | 105 | 1,02 | 7,5024·102 | 1,02·104 | ||
| 1 кгс/см2 | 9,8067·104 | 0,98067 | 104 | |||
| 1 мм рт.ст. | 1,33·10-3 | 1,36·10-3 | 13,6 | |||
| 1 мм вод.ст. | 9,8067 | 9,8067·10-5 | 10-4 | 7,35·10-2 |
Различают атмосферное или барометрическое давление рб, абсолютное давление ра, манометрическое или избыточное ризб, разрежение или вакуум рвак.
Давление, создаваемое атмосферным воздухом, называется барометрическим или атмосферным.
Абсолютным давлением ра называется давление, отсчитываемое от нуля (абсолютного вакуума).
Избыточным или манометрическим давлением называется давление сверх атмосферного, то есть избыточное давление — это разность между абсолютным и барометрическим давлениями: ризб = ра - рб.
Разрежением или вакуумом называется разность между атмосферным давлением и абсолютным давлением той среды, где измеряется давление. Если абсолютное давление газа или пара в сосуде ниже барометрического, то есть б, то разностьра - р называется разрежением или вакуумом.
Вакуум показывает, насколько давление газа (пара) меньше давления окружающей среды.
Давление атмосферного воздуха измеряется барометрами, избыточное давление — манометрами, а давление разрежения — вакуумметрами.
В термодинамических уравнениях всегда используют значения абсолютного давления ввиду того, что оно является параметром, характеризующим состояние термодинамической системы.
Атмосферное давление — величина переменная, поэтому в технике применяется нормальное атмосферное давление, ро = 101325 Па (760 мм рт. ст.).
Температура тела есть мера его нагретости. Температура определяет направление передачи теплоты. Если два тела А и В имеют соответственно температуру Т1 и Т2 и Т1>Т2, то теплота переходит от тела А к телу В. При этом температура тела А уменьшается, а тела В - увеличивается.
С точки зрения молекулярно-кинетической теории температура есть мера интенсивности теплового движения молекул.
В термодинамике рассматривают температуру как среднестатистическую величину, которая характеризует систему, состоящую из очень большого числа молекул (частиц), находящихся в хаотическом (тепловом) движении. Поэтому к единичным молекулам понятие температуры не применимо. При температуре абсолютного нуля тепловое движение молекул отсутствует. Эта предельная минимальная температура называется абсолютным нулем и является началом для отсчета температур. Понятно, что не может быть 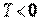 , то есть абсолютная температура всегда положительна.
, то есть абсолютная температура всегда положительна.
Температура, отсчитываемая от абсолютного нуля, называется абсолютной, а шкала температур называется шкалой Кельвина.
Практически измерять кинетическую энергию молекул газа непосредственно невозможно. Поэтому для измерения температуры используют различные косвенные методы. Температура измеряется при помощи различных термодинамических устройств - термометров).
Использование термометров основано на том факте, что два соприкасающихся тела с разными температурами через некоторое время приходят к состоянию теплового равновесия и принимают одинаковую температуру.
Численный отсчет температуры производится по шкале температур. За основную единицу измерения температуры принимают градус, имеющий разную величину в различных температурных шкалах. Шкала температур устанавливается путем деления разности показаний термометра в двух произвольно выбранных постоянных температурных точках, называемых реперными или опорными, на некоторое число равных частей — градусов.
Ввиду того, что выбор постоянных температурных точек и цены деления шкалы является произвольным, имеется ряд различных шкал температуры.
В настоящее время применяются следующие температурные шкалы: Цельсия, Фаренгейта, Реомюра, Ранкина.
По шкале Цельсия приняты следующие значения постоянных реперных точек: 0°C - температура таяния льда, 100°C - температура кипения воды при нормальных физических условиях (давление 101325 Па).
В 1724 г. Фаренгейт предложил термометр, в качестве реперных точек которого приняты: +212°F — температура кипения воды при нормальном атмосферном давлении; +32°F - температура таяния льда. Разность температур кипения воды и таяния льда по шкале Фаренгейта равна 212°- 32° = 180 °F, а по шкале Цельсия - 100°C. Следовательно, 1°F соответствует 5/9 °C, а 1°C - 1,8°F.
Шкала Реомюра имеет следующие реперные точки: О°R - температура таяния льда, 80°R - температура кипения воды при нормальном атмосферном давлении.
Шкала Ранкина - это шкала Фаренгейта, отсчитанная от абсолютного нуля. В этой шкале температура таяния льда (T0=273,15 К) соответствует 491,67°Ra, а температура кипения воды при нормальном атмосферном давлении (T0=373,15 К) соответствует 671,67°Ra.
Решением Международного комитета мер и весов приняты две шкалы: термодинамическая температурная шкала (Кельвина), которая принята основной и Международная практическая температурная шкала (МПТШ-68), выбранная таким образом, чтобы температура, измеренная по этой шкале, была близка к термодинамической. В основу построения термодинамической шкалы положен тот факт, что в циклах Карно, располагающихся между двумя адиабатами, разность температур изотерм считается постоянной, если в механическую работу превращаются одинаковые количества теплоты. Наиболее универсальной шкалой температур является абсолютная термодинамическая шкала температур — шкала Кельвина.
В шкале Кельвина используется единственная экспериментальная реперная точка — тройная точка химически чистой воды (в термодинамическом равновесии находятся три агрегатных состояния; лед, жидкая вода и пар). Этому состоянию соответствует температура 273,15К (0,01°С). Второй постоянной точкой является абсолютный нуль температур (0К). Кельвин — единица измерения температуры по термодинамической температурной шкале, равная 1/273,15 части интервала от абсолютного нуля температуры до температуры тройной точки воды.
Практическим осуществлением термодинамической шкалы температур является Международная практическая температурная шкала. В этой шкале используется одиннадцать реперных точек. В табл. 1.2 приведены значения основных реперных точек .
Таблица 1.2 Значения основных реперных точек
| Равновесное состояние | МПШТ-68 | |
| T68 | t68 | |
| Точка кипения кислорода | 90,188 К | -182,962 0C |
| Тройная точка воды | 273,16 К | +0,01 0C |
| Точка кипения воды | 373,15 К | +100,0 0C |
| Точка плавления цинка | 692,73 К | +419,58 0C |
| Точка плавления серебра | 1235,08 К | +961,93 0C |
| Точка плавления золота | 1337,58 К | +1064,43 0C |
| Температуры кипения и плавления даны при давлении 101325 Па |
Удельный объем вещества v - это объем, занимаемый единицей массы данного вещества.
Величина, обратная удельному объему и определяющая количество вещества, заключенного в единице объема называется плотностью вещества 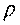 .
.
Единица плотности в СИ - кг/м3, в системе СГС - г/см3. Плотность и удельный объем зависят от температуры и давления, то есть от термодинамического состояния вещества. Обычно в справочниках приводятся их значения при нормальных физических условиях. За нормальные физические условия принимают давление, равное 101,325 кПа (760 мм рт. ст.) и температуру, равную 0 °С.
Количество вещества — это физическая величина, определяемая числом структурных элементов (атомов, молекул, ионов, электронов). Единицей количества вещества в СИ является моль. Кроме моля применяют кратные и дольные части от моля (кмоль, Ммоль и др.). Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг.
Молярной массой вещества называют отношение массы вещества к его количеству:
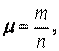
|
где μ - молярная масса. Если m задать в кг, а n - в молях, то μ - выразится в кг/моль.
1.4.2 Калорические параметры состояния
К калорическим параметрам состояния относятся, как уже отмечалось, внутренняя энергия 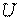 , энтальпия Н и энтропия
, энтальпия Н и энтропия 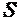 . Своим названием эти параметры обязаны тому, что ранее измерялись в калориях.
. Своим названием эти параметры обязаны тому, что ранее измерялись в калориях.
Дата добавления: 2016-03-27; просмотров: 1136;
