Занятие 7. Термодинамика
Задача 04.1.1.1
Вычислитьγпоказатель адиабатыдля газовой смеси, состоящей из ν1 = 2,0 моля кислорода и
ν2 = 3,0 моляуглекислого газа. Газы считать идеальными.
Дано: показатели адиабат для O2 кислорода γ1 =1, 40 и CO2 углекислого газа γ2 = 1, 30, количество молей O2 кислорода ν1 = 2,0 и CO2 углекислого газа ν2 = 3,0.Определить γпоказательадиабаты смеси.Молярная Cpтеплоемкость при постоянном давлениис учетом (4.57) из раздела 04.1.0 "Физическая термодинамика" имеет следующий вид: Cp = (i + 2)R/2, (1.1) где i - количество степеней свободы из параграфа "Закон равномерного распределения энергии по степеням свободы молекул" раздела 04.1.0 "Физическая термодинамика", котороедля двухатомноймолекулы O2 кислорода i = 5, для трёхатомноймолекулы CO2 углекислого газа i = 6; R = 8,314 Дж/(моль∙K) - универсальная газовая постоянная.
Показательγ (4.67)из раздела 04.1.0 "Физическая термодинамика" адиабаты имеет следующий вид: γ = Cp/CV, (1.2) где CV - молярная (4.52) из раздела 04.1.0 "Физическая термодинамика" теплоемкость при V постоянном объеме.
Подставляем (1.1) в (1.2) и решаем полученное выражение относительно молярной CV теплоемкости при V постоянном объеме, после чего получаем следующее выражение: CV = (i + 2)R/2γ, (1.3) Молярная (4.52) из раздела 04.1.0 "Физическая термодинамика" CVтеплоемкость при V постоянном объеме имеет следующий вид: CV = iR/2 ↔ i = 2CV/R. (1.4) Подставляем (1.4) в (1.3) и решаем полученное выражение относительно молярной CV теплоемкости при V постоянном объеме, после чего получаем следующее выражение:
CV = R/(γ -1). (1.5) C использованием (1.5) молярные CV1, CV2 теплоемкости при V постоянном объеме соответственно O2 кислорода, CO2 углекислого газа с учётом их γ1, γ2 показателей адиабат имеют следующий вид: CV1 = R/(γ1 -1); CV2 = R/(γ2-1). (1.6) ВнутренняяU (4.51) из раздела 04.1.0"Физическая термодинамика" энергия смеси O2 кислорода ν1 = 2,0 моля количеством с CO2 углекислым газом ν2 = 3,0 моля количеством имеет следующий вид: U = (ν1 + ν2)CVT. (1.7) где CV - молярная (4.52) из раздела 04.1.0 "Физическая термодинамика" теплоемкость смеси O2 кислорода с CO2 углекислым газом при V постоянном объеме при T температуре этой газовой смеси.
Подставляем в (1.7) выражение (1.5) молярной CV теплоемкости при V постоянном объеме, где
γ- показатель адиабатысмеси O2 кислорода и CO2 углекислого газа, и получаем следующее выражение
Uвнутреннейэнергии этой смеси: U = (ν1 + ν2)RT/(γ -1). (1.8) ВнутренняяU (4.51) из раздела 04.1.0"Физическая термодинамика" энергия смеси, выраженная через U1 и U2 внутренниеэнергии O2 кислорода ν1 = 2,0 моля количеством с CO2 углекислым газом ν2 = 3,0 моля количеством имеет следующий вид: U = U1 + U2 ↔ U = ν1 CV1T + ν2 CV2T. (1.9) Подставляем в (1.9) молярные CV1, CV2 теплоемкости при V постоянном объеме из (1.6) соответственно O2 кислорода и CO2 углекислого газа с учётом их показателейγ1, γ2 адиабат и получаем следующее выражение Uвнутреннейэнергии смеси этих O2 кислорода и CO2 углекислого газа: U = [ν1 R/(γ1 -1)T] +[ ν2 R/(γ2 -1)T]. (1.10) Выражения (1.8) и (1.10) определяют Uвнутреннюю энергию смеси O2 кислорода ν1 = 2,0 моля количеством с CO2 углекислым газом ν2 = 3,0 моля количеством. При этом в (1.8) выражении U внутренняя энергия включает в себя параметры смеси, т.е. γ- показатель адиабатысмеси и её общее
ν = (ν1 + ν2) количество молей, а в (1.10) выражении U внутренняя энергия включает в себя параметры компонентэтой смеси, т.е.γ1, γ2 показатели адиабат и ν1, ν2 количество молей соответственно O2 кислорода и CO2 углекислого газа. Поэтому эти два выражения (1.8) и (1.10) описывают один и тот же параметр, а именно Uвнутреннюю энергию смеси O2 кислорода ν1 = 2,0 моля количеством с CO2 углекислым газом ν2 = 3,0 моля количеством. Приравниваем выражения (1.8), (1.10) и решаем полученное выражение относительно требуемого в задаче γпоказателя адиабатысмеси O2 кислорода и CO2 углекислого газа, после чего получаем следующее выражение: (ν1 + ν2)RT/(γ -1) =
= [ν1 R/(γ1 -1)T] +[ ν2 R/(γ2 -1)T] ↔ γ = [ν1 γ1 (γ2 -1) + ν2 γ2 (γ1 -1)] /[ν1 (γ2 -1) + ν2 (γ1 -1)].(1.11) Задача 04.1.1.2
Один моль кислорода, находившегося при T1 = 290 K температуре, адиабатическисжали так, что его давление возросло в η = 10 раз. Найти: а) температуру T2 газа после сжатия; б) работу A′, которая была совершена над газом.
|
|
| |
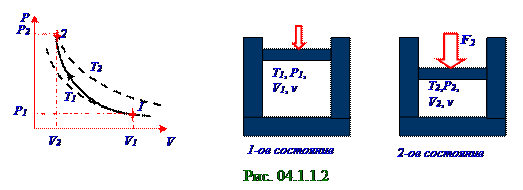
РаботаA12′ (рис. 04.1.1.2)вектора F внешнейсилы, которая равняется по модулю и противоположнапо знаку A12 работегаза в адиабатическом процессе(4.103)из раздела 04.1.0 "Физическая термодинамика" по сжатиюO2 кислорода ν = 1,0 моль количеством из 1-ого состояния с V1 объёмом во 2-ое состояние с V2 объёмом, в результате чего температураэтогогаза возрастаетот значения T1 до значения T2, имеет следующий вид: A12′ = CV ν(T2 - T1). (2.1)
Подставляем в (2.1) выражение (1.5) из"Задача 04.1.1" молярной CV теплоемкости при постоянном V объеме O2 кислорода с учётом его γпоказателя адиабаты и получаем работуA12′
(рис. 04.1.1.2)вектора F внешнейсилы по сжатиюO2 кислорода ν = 1,0 моль количеством из 1-ого состояния с V1 объёмом во 2-ое состояние с V2 объёмом, в результате чего температураэтогогаза возрастаетот значения T1 до значения T2, которая имеет следующий вид: A12′ = νR(T2 - T1)/(γ -1). (2.2) Уравнение Пуассона(4.71) из раздела 04.1.0 "Физическая термодинамика" в параметрах
P давления и T температуры для 1-ого состояния и 2-ого состояния с учётом условия задачи имеет следующий вид: P1T1γ/(1-γ) = P2T2γ/(1-γ) ↔ P1T1γ/(1-γ) = ηP1T2γ/(1-γ) ↔ T2 = T1η( γ-1)/γ. (2.3) Подставляем (2.3) в (2.1) и получаем A12′ работу(рис. 04.1.1.2)вектора F внешнейсилы по сжатиюO2 кислорода ν = 1,0 моль количеством от начальнойT1 температуры с увеличением первоначальногоP1 давления в η раз, которая имеет следующий вид: A12′ = νRT1[η( γ-1)/γ - 1]/(γ -1) , Дж. (2.4) Задача 04.1.1.3
Имеется идеальный газ с γпоказателем адиабаты. Его C молярная теплоёмкость при некотором процессе зависит от T температурыэтого идеального газа в соответствии со следующим выражением: C = α/T, где α, Дж - известный размерный коэффициент. Найти: а) работу A12, совершённую одним молем идеального газа при его нагреве от T1 температуры до T2 температуры, в η раз большей;
б) уравнение процесса в параметрах P давленияи V объёма.
Дано: C = α/T; T2 = ηT1; γ / A12 = ? P(V) = ?
а) Первое начало термодинамики (4.7) из раздела 04.1.0 "Физическая термодинамика" в дифференциальномвиде имеет следующий вид: δQ = dU + δA. (3.1)
С учётом (4.46) из раздела 04.1.0"Физическая термодинамика" элементарного количества δQ теплоты, сообщаемого одному молю идеального газа, бесконечноdUмалогоизменения внутреннейэнергии(4.49) из раздела 04.1.0 "Физическая термодинамика"этого одного моля идеального газа а также с учётом δAэлементарнойработы (4.12) из раздела 04.1.0"Физическая термодинамика", выполненной идеальным газом, выражение (3.1) принимает следующий вид: CdT = CVdT + pdV, (3.2)
|
Работа A12, совершённая одним молем идеального газа при его нагреве от T1 температуры до T2 температуры, в η раз большей, определится интегрированием (3.3) в пределах от значения T1 до значения T2 = ηT1 температуры: V2 ηT1 ηT1
A12 =∫ pdV = ∫αdT/T - ∫RdT/(γ -1)= (αlnη) - [RT1(η -1)/(γ -1)]. (3.4) V1 T1 T1
где V1, V2 - начальный и конечный объёмы идеального газа при его нагреве от T1 температуры до
T2 температуры, в η раз большей.
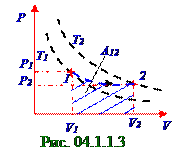
Графически (рис. 04.1.1.3) работа A12, совершённая идеальным газом, представляет собой площадь под ориентировочной кривой зависимости P давленияот V объёма идеального газа, представленной на рис. 04.1.1.3 штриховой синей линией,при его нагреве от T1 температуры до T2 температуры, в η раз большей, что соответствует изменению объёма этого идеального газа от V1 начальногодо V2 конечного объёма.
Штриховой чёрной линией на рис. 04.1.1.3 изображены две изотермы, которые соединяют те точки на плоскости P давленияи V объёма идеального газа, при значении которых этот идеальный газ имеет постоянную T температуру. В частности в 1-ом состоянии, которому соответствуют P1 давлениеи V1 объём идеального газа, этот идеальный газ имеет T1 температуру, поэтому нижняя изотермапроходит через 1 точку на плоскости P давленияи V объёма идеального газа. Во 2-ом состоянии, которому соответствуют P2 давлениеи V2 объём идеального газа, этот идеальный газ имеет
T2 температуру, поэтому верхняя изотермапроходит через 2-ую точку на плоскости P давленияи
V объёма идеального газа.
б) Преобразовываем (3.3) в вид, удобныйдля интегрирования, после чего получаем следующее выражение для одного моляидеального газа: pdV - (αdT/T) + RdT/(γ -1)= 0. (3.5)
Подставляем в (3.5) P давлениес использованием (4.13) из раздела 04.1.0 "Физическая термодинамика" уравнения Клапейрона –Менделеевадля одного моляидеального газа: P = RT/V, после чего получаем следующее выражение:
(RTdV/V) - (αdT/T0 )+ [RdT/(γ -1)] = 0 ↔ (dV/V) + [1/(γ -1)]dT/T = (α/R)(dT/T2). (3.6)
Производим интегрирование (3.6) от начального V0 доконечногопеременного Vобъёма идеального газа, которым соответствует начальная T0 и конечнаяпеременная T температура этого идеального газа, после чего получаем следующее выражение: V T T
∫ dV/V + [1/(γ -1)]∫dT/T = (α/R)∫dT/T2 ↔ V0 T0 T0
↔ lnV/V0 + [1/(γ -1)]lnT/T0 = (α/R)[(1/T) - (1/T0 )]. (3.7)
Подставляем в (3.7) T температуру с использованием (4.13) из раздела 04.1.0 "Физическая термодинамика" уравнения Клапейрона –Менделеевадля одного моляидеального газа:
T = PV/R, T0 = P0V0/R,после чего получаем следующее выражение:
lnV/V0 + [1/(γ -1)]ln pV/ p0V0 = α [(1/pV) - (1/p0V0)] ↔ ↔ ln(V/V0) (pV/p0V0) 1/(γ -1) = α [(1/pV) - (1/p0V0)]. (3.8)
Производим потенцирование (3.8) и получаем следующее выражение уравнение процесса в параметрах P давленияи V объёмадля одного моляидеального газа, у которого C молярная теплоёмкость зависит от T температурыэтого идеального газа в соответствии с C = α/T выражением:
(V/V0)(PV/P0V0) 1/(γ -1) = eα/PVe-α/P0V0 ↔ (V/V0) γ -1(PV/P0V0) = eα(γ -1)/PVe-α(γ -1)/P0V0 ↔ PV γe-α(γ -1)/PV = const,(3.9)
где const = P0V0 γ e-α(γ -1)/P0V0 - постоянное значение, получаемое подстановкой в выражение const начальных P0,V0 соответственнодавления,объёма, связанных с начальной T0 температурой уравнением (4.13) из раздела 04.1.0 "Физическая термодинамика" Клапейрона –Менделеевадля одного моляидеального газа: T0 = P0V0/R.
Произведение P0V0 начальных давления и объёмаили начальной T0 температурыодного моляидеального газа для определения уравнение процесса в параметрах P давленияи V объёма должно задаваться в условии задачи.
Задача 04.1.1.4
Определить количество поглощённого Q тепла при расширении одного моля реального газа от V1 до V2 величины объёма, если T температура этого газа при расширении постоянна.
Газ считать ван-дер-ваальсовским. Дано: V1; V2; ν = 1 моль / Q = ?
 |

Поскольку T температура ван-дер- ваальсовского газа при расширении постоянна, т.е. dT = 0, то (4.1) дифференциал dU внутреннейэнергии принимает следующий вид: dU = (a/V2)dV. (4.2) Уравнение (4.13) из раздела 04.1.0 "Физическая термодинамика" Клапейрона – Менделеевадля одного моля эквивалентногоидеального газа имеет следующий вид: P'V' = RT,(4.3)
где P′, V′ - соответственно(рис. 04.1.1.4)давление(4.109)из раздела 04.1.0 "Физическая термодинамика" и объём(4.110) из раздела 04.1.0 "Физическая термодинамика" идеальногогаза, эквивалентногопо своим свойствам ван - дер - ваальсовскому газус P давлениемна стенки сосудаи V объёмом;
T - температура ван-дер-ваальсовского газа, равная T температуреэквивалентногоидеального газа.
Подставляем в (4.2) P′ = P + (a/V 2) давление(4.109)из раздела 04.1.0 "Физическая термодинамика", V′ = V - bобъём(4.110) из раздела 04.1.0 "Физическая термодинамика" эквивалентного идеальногогаза и получаем следующее выражение (рис. 04.1.1.4) Pдавленияна стенки сосуда одного моляван-дер-ваальсовского газа, имеющего T температуру:
[P + (a/V 2)](V - b) = RT ↔P = [RT/(V - b)] - (a/V2). (4.4)ЭлементарнаяδA = PdV работа (4.12) из раздела 04.1.0 "Физическая термодинамика", выполненная одним молемгаза Ван - дер - Ваальса, с учётом (4.4) выражения Pдавленияна стенки сосуда этогогазаВан - дер - Ваальса, имеющего T температуру, имеет следующий вид: δA = PdV = [RT/(V - b)]dV - (a/V2)dV, (4.5)где b - постоянная, определяемая физико - химическими свойствами молекул газа.
Согласно (4.10) из раздела 04.1.0 "Физическая термодинамика" первым началом термодинамикив интегральном видеQ12 теплота дляперевода термодинамическойсистемы
(рис. 04.1.1.4) из 1-ого состояния с V1 объёмомво 2-ое состояние с V2 объёмомс учетом (4.2) и (4.5) имеет следующий вид:
2 2 2 V2 V2
Q12 = ∫ δQ = ∫ dU + ∫ δA ↔ Q12 = ∫ (a/V2)dV + ∫ [RT/(V - b)]dV - (a/V2)dV ↔
1 1 1 V1 V1
↔ Q12 = RT ln[(V2 - b)/(V1 - b)].(4.6)
Задача 04.1.1.5
Найти для одного моляван-дер-ваальсовского газа уравнение адиабатического процесса в параметрах T температурыи V объёма, у которого известна CV молярная теплоемкость этого ван-дер- ваальсовского газа при V постоянном объеме.
|

ван - дер - ваальсовскому газус P давлениемна стенки сосудаи V объёмом; T - температура ван-дер-ваальсовского газа, равная T температуреэквивалентногоидеального газа.
Подставляем в (4.1) P′ = P + (a/V 2) давление(4.109)из раздела 04.1.0 "Физическая термодинамика", V′ = V - bобъём(4.110) из раздела 04.1.0 "Физическая термодинамика" эквивалентного идеальногогаза и получаем следующее выражение Pдавленияна стенки сосуда одного моляван-дер-ваальсовского газа, имеющего T температуру: [P + (a/V 2)](V - b) = RT ↔
P = [RT/(V - b)] - (a/V 2). (5.2)
Изменение dU внутреннейэнергии газа Ван - дер - Ваальсасогласно первому началутермодинамики (4.113) из раздела 04.1.0 "Физическая термодинамика" в дифференциальномвиде для адиабатическогопроцесса принимает следующий вид: dU = - δA ↔ dU = - PdV. (5.3)
где dU - дифференциалвнутреннейэнергии газа Ван- дер- Ваальса(4.116) из раздела 04.1.0 "Физическая термодинамика", выполненная газом Ван- дер- Ваальса.
Дифференциал dU внутреннейэнергии одного молягаза Ван- дер- Ваальса(4.116) из раздела 04.1.0 "Физическая термодинамика" имеет следующий вид:
dU = (∂U/∂T)dT + (∂U/∂V)dV = {∂[CVT - (a/V)]/∂T}dT + {∂[CVT - (a/V)]/∂V}dV = CV dT + (a/V2)dV. (5.4)
ЭлементарнаяδA = pdV работа (4.12) из раздела 04.1.0 "Физическая термодинамика", выполненная одним молемгаза Ван - дер - Ваальса, с учётом (5.2) выражения Pдавленияна стенки сосуда этогогазаВан - дер - Ваальса, имеющего T температуру, имеет следующий вид: δA = PdV = [RT/(V - b)]dV - (a/V 2)dV. (5.5)
Подставляем (5.4) дифференциал dU внутреннейэнергии и (5.5) элементарную
δA = pdV работу в выражение (5.3) первого началатермодинамики в дифференциальномвиде для адиабатическогопроцесса и получаем следующее дифференциальное уравнение с разделяющимися переменными относительно параметров T температурыи V объёма одного молягаза Ван - дер - Ваальса: CV dT + (a/V)2dV = - [RT/(V - b)]dV + (a/V 2)dV ↔ dT/T = - R/CV dV/(V - b). (5.6)
Производим интегрирование (5.6) от начального V0 доконечногопеременного Vобъёма газа Ван - дер - Ваальса, которым соответствует начальная T0 и конечнаяпеременная T температура, после чего получаем следующее уравнение процесса в параметрах T температуры и V объёмадля одного моляэтогогаза Ван - дер - Ваальса, у которого молярная теплоемкостьпри V постоянном объеме равна CV: T V
∫dT/T = - R/CV ∫dV/(V - b) ↔ ln (T/T0) = ln[(V - b)/(V0 - b)]-αR/CV ↔ T0 V0
↔ T/T0 = [(V - b)/V0]- α ↔ T(V - b) α = T0 (V0 - b) α = const, (5.7)
где α = R/CV.
Начальные T0,V0 соответственнотемпературы,объёма одного молягаза Ван - дер - Ваальса для определения уравнение процесса в параметрах T температуры и V объёма должно задаваться в условии задачи.
| <== предыдущая лекция | | | следующая лекция ==> |
| Элементы релятивистской механики | | | Статистическое описание равновесных состояний термодинамических систем: одно -, дву – и трехмерные функции распределения 1 страница |
Дата добавления: 2016-02-14; просмотров: 907;
