Микроорганизмы как объект биотехнологии
Из более ста тысяч известных видов микроорганизмов в промышленности используют около 100 видов, к которым принадлежат несколько тысяч штаммов.
Использование микроорганизмов и продуктов их синтеза с каждым годом непрерывно расширяется. Разнообразие областей применения и свойств продуктов микробиологического синтеза затрудняет нахождение общих закономерностей в способах их получения. Так, культивирование микроорганизмов может осуществляться периодическим, полунепрерывным или непрерывными методами, в аэробных или анаэробных условиях, что существенно влияет на применяемые аппаратуру и технологические приемы. Принципиальные отличия связаны и с конечным объектом культивирования, под которым можно понимать биомассу микроорганизмов либо вторичных метаболитов, т.е. веществ, синтезируемых микроорганизмами (антибиотиков, ферментов, аминокислот). Это в конечном итоге определяет условия культивирования, что учитывают напрямую или косвенно. Важно помнить, что необходимо выращивать микроорганизмы в условиях строгой чистоты культуры, что связано со стерилизацией как основной, так и вспомогательной аппаратуры, а также всех используемых компонентов; культивирование микроорганизмов осуществляется в трехфазных системах «газ-жидкость-твердое тело (клетки)» с меняющимися по ходу процесса реологическими свойствами, в связи с чем общепринятые зависимости для расчетов гидродинамики массообмена в этих системах практически не могут быть использованы (особую трудность представляет адаптация лабораторных и стендовых установок к промышленным условиям); использование больших объемов воздуха как наиболее экономичного источника кислорода продиктовано низкой его растворимостью в питательных средах и культуральных жидкостях; микроорганизмы чувствительны к воздействию физико-химических и механических факторов и низкая по сравнению с химическими реакциями скорость процессов биосинтеза; многокомпонентные питательные среды и культуральные жидкости способны к образованию стабильных пен; биохимические механизмы регуляции роста микроорганизмов и биосинтез целевых продуктов отличается многообразием и сложностью; в ряде случаев целевые продукты нестабильны под воздействием внешних факторов.
Обычно можно выделить следующие периоды жизни микроорганизмов: скрытый (латентный, лагфаза), период логарифмического роста и период ослабления и гибели. Скрытый период зависит от природы и возраста первичных микроорганизмов, состава среды и от того, насколько микроорганизмы приспособлены к жизнедеятельности в данной среде.
В период логарифмического роста обычно протекают процессы ферментации. Предположим, что rМ - масса микроорганизмов в пересчете на сухое вещество на единицу объема среды; rS - масса субстрата на единицу объема среды, а скорость роста 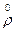 м является функцией rМ и rS. Для периода логарифмического роста
м является функцией rМ и rS. Для периода логарифмического роста 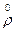 М пропорциональна rм. Влияние среды на скорость роста является более сложным. Это побудило Monod ввести параметр удельной скорости роста:
М пропорциональна rм. Влияние среды на скорость роста является более сложным. Это побудило Monod ввести параметр удельной скорости роста:
u= 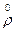 М/rМ=dlnrм/dt. (3.11)
М/rМ=dlnrм/dt. (3.11)
Если mм обозначает общую сухую массу микроорганизмов, а V - объем среды в ферментере, то получаем:
u= 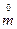 М/rМ. (3.12)
М/rМ. (3.12)
В период логарифмического роста удельная скорость роста является постоянной, а продолжительность времени, необходимого для увеличения количества микроорганизмов в два раза, составляет:
Dt=ln2/u=0,693/u (3.13)
При малых значениях rS на рост микроорганизмов в значительной степени влияет концентрация субстрата. С увеличением rS это влияние ослабевает и параметр u стремится к асимптотическому значению umax. Следовательно уравнение для удельной скорости роста:
u= umax[rS/(kS+rS)] (3.14)
Константа kS численно равна концентрации субстрата, при которой скорость роста равна половине максимальной скорости роста. Скорость роста микроорганизмов при 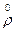 Мmax=umax
Мmax=umax 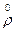 М выражается уравнением:
М выражается уравнением:
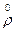 М= umax[rS/(kS+rS)] rМ. (3.15)
М= umax[rS/(kS+rS)] rМ. (3.15)
Переход от плотности rМ к массе mM приводит к уравнению:
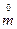 М= umax[rS/(kS+rS)] mМ. (3.16)
М= umax[rS/(kS+rS)] mМ. (3.16)
Модель Моно хорошо согласуется с экспериментальными результатами, отражающими рост большинства одноклеточных организмов в гомогенных средах. Приведенные формулы позволяют учитывать колебания концентрации субстрата при постоянстве условий окружающей среды (рН, температура, вторичный субстрат и т.д.). Если эти условия изменяются во время процесса роста, то появляются изменения и в umax и kS. Естественно, расчетные выражения необходимо модифицировать, если на скорость роста микроорганизмов влияет скорость диффузии субстрата, что имеет место, например, при росте плесеней в процессе созревания некоторых сортов сыра.
В зависимости от значений концентрации субстрата общую константу скорости kr можно определить, воспользовавшись одним из следующих соотношений, характеризующих реакции ферментов:
- для низкой концентрации субстрата:
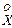 Р= krХS; (3.17)
Р= krХS; (3.17)
- средней концентрации субстрата:
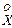 Р= krХSХЕ; (3.18)
Р= krХSХЕ; (3.18)
- для высокой концентрации субстрата:
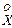 Р= krХi. (3.19)
Р= krХi. (3.19)
Зависимостями, определяющими скорость роста микроорганизмов, являются:
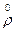 М= krrS;(3.20)
М= krrS;(3.20)
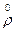 М= krrSrM;(3.21)
М= krrSrM;(3.21)
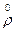 М= krrM.(3.22)
М= krrM.(3.22)
Во всех этих случаях kr связана с температурой среды уравнением Аррениуса:
kr=ke-E/RT, (3.23)
где E - энергия активации, отнесенная к 1 кмоль.
Температурную зависимость константы скорости при рассмотрении скорости роста микроорганизмов можно представить в форме уравнения Аррениуса, при этом «моль» микроорганизмов - понятие условное.
Логарифмируя уравнение Аррениуса, а затем дифференцируя полученное выражение по температуре, получим:
dln kr/dT=E/RT12. (3.24)
Если kr1 является константой скорости реакции при температуре среды T1 а kr2 - константой скорости при температуре T2, то интегрируя формулу (3.24), получаем:
ln 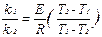 . (3.25)
. (3.25)
Следовательно, влияние температуры на константу скорости можно выразить через энергию активации. Численное значение E не постоянно, но для реакций ферментов и роста микроорганизмов оно обычно равно (3-12)´107 Дж×кмоль-1.
Используют и другие экспериментальные методы получения температурной зависимости константы скорости. Отношение констант скорости при повышении температуры среды на 10оС в научной литературе по биологии и биохимии обозначают Q10, а повышение температуры, необходимое для увеличения константы скорости в 10 раз, - Du10.
Следует отметить, что уравнение Аррениуса и другие выражения температурной зависимости применимы только в нормальном диапазоне изменения активности микроорганизма или фермента. Этот диапазон ограничен минимальной температурой роста микроорганизмов или реакции ферментов, а сверху температурой начала инактивации. За пределами этого диапазона влияние температуры на константу скорости определяется другими факторами, например, денатурацией белков.
Кинетика метаболизма определяется штаммом микроорганизмов, составом среды, степенью перемешивания и температурой среды, в результате чего представление зависимостей в математической форме весьма затруднительно. Промышленные штаммы должны расти на дешевых и доступных субстратах; обладать высокой скоростью накопления биомассы и давать высокую продуктивность целевого продукта при экономичном потреблении питательного субстрата; проявлять направленную биосинтетическую активность при минимальном образовании побочных продуктов; быть генетически однородными, стабильными в отношении продуктивности и требований к питательному субстрату и условиям культивирования; быть устойчивы к фаготипам и другой посторонней микрофлоре; быть безвредными (не обладать патогенными свойствами). При этом желательно, чтобы продуценты были термофильными и ацидофильными (или алкалофильными), т.к. в этом случае легче предохранить ферментированный субстрат от инвазии посторонней микрофлорой. Целевой продукт биосинтеза должен иметь хозяйственную ценность и должен легко выделяться из субстрата.
В промышленности применяют три группы штаммов: природные штаммы, улучшенные естественным или искусственным путем; штаммы, измененные в результате мутаций и штаммы, полученные генной (клеточной) инженерией. Сознательную селекцию микроорганизмов проводят двумя путями: отбирают штаммы микроорганизмов, у которых существенно увеличена продуктивность, либо генетически меняют программу биосинтеза необходимых веществ. Селекция микроорганизмов имеет свои особенности. В качестве исходного материала селекции у исследователей находится особь клона, под которой понимают биологический объект, имеющий генетическую однообразность с исходной (материнской) клеткой, т.е. у большинства микроорганизмов один набор хромосом. Однако при этом клон микроорганизмов быстро достигает большой численности за счет естественных мутаций и превращается в популяцию - совокупность клеток с разными генотипами. У большинства микроорганизмов не выявлена способность к гибридизации (половому размножению), то есть селекцию клеток можно вести только вегетативным путем.
Благодаря тому, что микроорганизмы характеризуются быстрой сменой поколений, возможности для отбора положительных экземпляров значительно больше. Однако при этом для оценки свойств каждого клона требуется большая работа с использованием сложных биохимических и химических тестов, что делает процесс селекции исключительно трудоемким.
Для селекции используют музейные культуры (коллекционные культуры), известные промышленные продуценты либо объекты, выделенные из биологических субстратов.
В последнее время все большее распространение получает гибридизация как метод селекции в микробиологии, суть которой заключается в слиянии ядер микроорганизмов с образованием диплоидного ядра. Благодаря этому получена возможность получения рекомбинантного гибрида, в котором объединена генетическая информация разных видов. Благодаря гибридизации получены возможности для объединения в одной клетке желаемых свойств двух и более штаммов (видов); установлены возможности использования рекомбинированных хромосом для появления новых комбинаций ДНК в гибриде, что является причиной появления у него новых (оригинальных) или усиления уже имеющихся свойств.
У популяций микроорганизмов есть существенный недостаток: они подвержены обратному мутированию (реверсии), т.е. являются нестабильными. В большинстве случаев в промышленных условиях не удается обеспечить селективные преимущества мутантам, их приходится регулярно клонировать и отбирать из популяции клеток активные клоны.
Наиболее распространенным способом сохранения активности и жизнеспособности штаммов при длительном хранении являются периодические пересевы продуцента на свежие питательные среды. Однако при этом не исключена возможность реверсии, которой можно избежать консервированием.
К способам консервирования относятся замораживание (наиболее перспективный способ в атмосфере жидкого азота при минус 196оС). Обычно после 3-5-летнего хранения в таких условиях выживаемость микроорганизмов составляет 40-70 %, после 10-20-летнего хранения - 10-20%. Доступным способом консервации является хранение культур под слоем минерального масла, которое предохраняет субстрат от высыхания и ограничивает доступ атмосферного кислорода. Культуры грибов удобно хранить на естественно или принудительно высушенных питательных субстратах.
Все большее распространение приобретает лиофилизация, под которой понимают процесс удаления воды при пониженном давлении из замороженного продукта, минуя жидкое состояние. Микробные культуры лиофилизируют при температуре минус 45-60оС в течение 1-2 часа при остаточном атмосферном давлении 200-500 мм ртутного столба. Для повышения выживаемости клеток перед лиофилизацией их обрабатывают в защитных средах (бычья или лошадиная сыворотки, 1 %-й раствор желатина), которые регулируют осмотическое давление при лиофилизации. Для большинства культур с целью повышения выживаемости разработаны схемы по выводу из анабиоза (методики реактивации).
Сухой бактериальный концентрат вырабатывается из жидкого препарата (с защитной средой) путем его сублимационной сушки. Способ сублимационной сушки заключается в высушивании бактериального концентрата в замороженном состоянии при глубоком вакууме. При этом содержание микробных клеток в 1 г сухого бактериального концентрата повышается до сотен миллиардов клеток, а продолжительность хранения увеличивается до 4 месяцев.
Сухие бактериальные препараты вырабатывают из жидких путем их сушки методом распыления или сублимации. При производстве сухих заквасок с помощью распылительных сушилок активность чистых культур сохраняется до 3 месяцев. При сублимационном способе сушки сохраняемость живых клеток составляет 90 % в течение нескольких месяцев и даже лет.
Сухие бактериальные закваски и концентраты в отличие от жидких являются наиболее транспортабельными и могут сохраняться в течение длительного времени. При использовании сухого бактериального концентрата упрощается схема приготовления заквасок беспересадочным способом. Сухой бактериальный концентрат активизируется путем растворения его в стерилизованной питательной среде и выдержки в течение 1,5-3 часа при оптимальной температуре развития бактериальных клеток. После активизации бактериальный препарат направляется непосредственно в производство или для получения первичной производственной закваски.
В настоящее время за рубежом и у нас в стране ведутся активные поиски сред для производства заквасок. Составляющими компонентами таких сред являются дрожжевой экстракт, витамины, аминокислоты, специальные буферные смеси (фосфаты). Дрожжевой экстракт производится на основе патоки и служит для освобождения низкомолекулярных протеинов пептидов и аминокислот. Добавление витаминов, аминокислот и микроэлементов служит для оптимизации питательных качеств. Буферные смеси должны замедлять снижение уровня рН путем нейтрализации молочной кислоты, образованной бактериями, т.к. слишком низкое значение рН может привести к замедлению роста жизнеспособных бактерий. По сравнению с использованием обезжиренного молока, использование сред имеет следующие преимущества: среды не содержат ингибиторов; среды негативно влияют на бактериофаги за счет связывания фосфатами при нагреве свободных ионов кальция, которые необходимы большинству бактериофагов для проникновения в клетки бактерий. В настоящее время в производстве многих видов продуктов распространение получили лиофилизированные закваски.
При прямом внесении лиофилизированных заквасок, в сравнении с подготовкой материнской и производственной заквасок, прослеживаются следующие преимущества: более простое использование; более низкий фагориск, поскольку отсутствует многоступенчатый процесс подготовки заквасок; снижен риск внесения посторонней микрофлоры; снижена возможность изменения состава штамма (этот процесс может происходить при каждом новом выращивании культуры в результате неточного соблюдения технологических режимов или мутации в сторону преимущества отдельных штаммов); гарантия по обеспечению стабильного качества продукта.
Кроме того, нет необходимости в обслуживающем персонале, строительстве заквасочных отделений и приобретении заквасочного оборудования. Одно из главных достоинств использования лиофилизированных культур - получение ферментированных продуктов высокого качества с большими сроками хранения.
Как было ранее отмечено, селекция является длительным и трудоемким процессом. Возможности селекции значительно расширяет генная инженерия, благодаря которой возможно: изменять и интенсифицировать функции отдельных генов, т.е. улучшать эффективность штамма, не вводя новую генетическую информацию, а модифицируя его собственную; выделять определенный ген и получать мутации, умножать число копий в клетке, интенсифицируя таким образом синтез продукта; расширять спектр используемых субстратов, создавать штаммы, способные утилизировать ксенобиотики; комбинировать гены микроорганизмов с генами других биологических объектов; конструировать новые гены.
Первый этап реализации принципов генной инженерии заключается в получении генов, содержащих необходимую информацию. В дальнейшем подбирают носитель, на котором можно поместить молекулу ДНК в биологический объект (в клетки хозяина) с последующим запуском наследственной информации введенного гена.
Как известно, в биотехнологии стоимость сырья в готовой продукции составляет 40-65 %. В микробиологической промышленности около 90 % сырья идет на производство этанола, 5 % - на производство хлебопекарных дрожжей, 1,7 % - на антибиотики.
Каждый вид микроорганизмов весьма избирателен к питательным веществам, а органическое сырье, за исключением лактозы, сахарозы и крахмала без предварительной подготовки малопригодно для микробного синтеза. К основным источникам сырья следует отнести крахмалы, мелассу, солодовое сусло, парафины, некоторые фракции нефти, гидролизаты торфа и древесных опилок, пшеничные отруби. У большинства микробов жизнедеятельность зависит от наличия азота, минеральных элементов и их солей, витаминов, органических жирных кислот и аминокислот. Обязательными факторами роста являются вода и кислород (для аэробов).
Существует много видов продуктов, технология которых предусматривает использование различных видов микроорганизмов: брожение, ферментативное созревание продуктов (пива, вина) приготовление теста. Особенно широко микроорганизмы используют в производстве молочных продуктов. Под действием внутриклеточных ферментов в молоке происходят различные химические и биохимические изменения. После гибели клеток микроорганизмов их ферментные системы продолжают изменять состав и свойства продуктов (ферментирование).
Дата добавления: 2016-03-22; просмотров: 1957;
