Молекулалардың электрондық спектрлерінің теориялық негіздері
Молекуланың ішінде көршілес электрондық деңгейлердің арасында ауысулар болу үшін сәйкес келетін кванттардың жиілігі сәулеленудің көрінетін және ультракүлгін (УК) диапазонына сәйкес келетіндей болуы қажет, ал олардың энергиясы химиялық байланыстың диссоциация энергиясінікі сияқты реттілікте болуы керек, яғни УК-фотон молекуланы бұза алатындай болады. Бірақ, көп жағдайда, осындай фотонды жұтқан молекула негізгі күйге әр түрлі фотофизикалық процестердің әсерінен ауысады, ал конденсацияланған фазаларда қозған молекуланың артық энергиясы бүкіл бөлшектер ұжымына тез таралып шашырайды. Электрон спектрлерінің түріне тербелмелі және айналмалы еркіндік дәрежелері күшті әсер етеді, себебі олар электрон ауысуларымен бір мезгілде қозады. Сондықтан белгілі электрондық ауысуға сәйкес келетін бір сызықтың орнына, тербелмелі ауысу сызықтарының үлкен сериясы пайда болады, ал осылардың әр қайсысы молекулалардың айналуымен түсіндірілетін күрделі жіңішке құрылымнан тұрады. Бір электрондық ауысуға сәйкес келетін әр түрлі тербелмелі және айналмалы сызықтардың толық жиынтығы бір спектрлі жолақты береді. Мұндай жолақтарды газ спектрлерінде бақылауға болады.
Молекулалардың өзара және еріткішпен әсерлесуі нәтижесінде ерітіндінің жұтылу спектрінде жіңішке құрылым байқалмайды, бірақ кейде жеке тербелістерге сәйкес келетін максимумдар көрінеді. Электрондық ауысу сызықтарының тербелмелі құрылымының мысалы ретінде алкандарда ерітілген ароматтық көмірсутектердің спектрлерін қарастыруға болады.
Электрондық жұтылу спектрлерінің дәл кванттық-механикалық түсіндірмесі тек қарапайым молекулалар үшін ғана мүмкін бола алады. Ал негізінде спектроскопияның осы түрі электрондық деңгейлердің энергиясы бір немесе бірнеше атом ядроларын қоршаған ортаның түріне тәуелділігімен байланысты болатын таза эмпирикалық сипатқа ие болады. Теориялық модельдер бір электрондық жақындастырумен ғана шектеледі, себебі модельдің күрделенуі негізгі сапалы шешімдерді өзгертпейді.
Молекулалардың спектрлі қасиеті олардың құрамындағы валенттік электрондардың түріне қарай жүйелендіріледі. Қарапайым байланыс түзетін электрондар 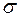 -электрондар деп аталады; қос байланыс түзсе –
-электрондар деп аталады; қос байланыс түзсе – 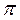 -электрондар деп аталады. Сонымен қатар, егер молекуланың құрамында азот, оттегі және т.б. бөлінбеген жұбы бар элементтердің атомдары бар болса, онда n-электрондар деп аталады.
-электрондар деп аталады. Сонымен қатар, егер молекуланың құрамында азот, оттегі және т.б. бөлінбеген жұбы бар элементтердің атомдары бар болса, онда n-электрондар деп аталады.
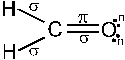
|
Валенттік электрондардың осы үш түрін формальдегид мысалында көрсетуге болады:
Молекуланың электрондық толқындық функциясын қарастырған кезде МО АОСК әдісін қолданады, яғни осы функцияны жуықтап алғанда бір электронды функцияның – молекулалық орбитальдардың (МО) – көбейтіндісі ретінде қарастырады, ал МО, өз кезегінде, атомдық орбитальдардың сызықты комбинациясы (АОСК) түрінде жазылады. Атомдардың бірігуіне алып келетін байланыстыратын орбитальдар 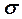 мен
мен 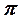 және атомдардың бөлініп кетуіне алып келетін антибайланыстыратын немесе қопсытқыш орбитальдар
және атомдардың бөлініп кетуіне алып келетін антибайланыстыратын немесе қопсытқыш орбитальдар 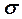 * мен
* мен 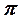 *болып бөлінеді.Химиялық байланыстың түзілуіне қатыспайтын бөлінбеген жұптардың электрондары байланыстырмайтын орбитальдарды n түзеді.
*болып бөлінеді.Химиялық байланыстың түзілуіне қатыспайтын бөлінбеген жұптардың электрондары байланыстырмайтын орбитальдарды n түзеді.
1-суретте формальдегидтің МО салыстырмалы энергия деңгейлері келтірілген (берік байланысқан электрондар суреттің астыңғы бөлігіндегі МО орналасқан).

Ең төменгі орбитальдар – үш байланыстыратын 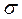 -орбитальдар, ең жоғарғысы – үш антибайланыстыратын
-орбитальдар, ең жоғарғысы – үш антибайланыстыратын 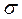 -орбитальдар болып табылады. Сонымен қатар байланыстыратын және антибайланыстыратын
-орбитальдар болып табылады. Сонымен қатар байланыстыратын және антибайланыстыратын 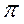 -орбитальдар және О атомының электронының бөлінбеген жұбы түзетін екі байланыстырмайтын n-орбитальдары болады. Молекуланың негізгі электрондық күйінде барлық байланыстыратын және байланыстырмайтын орбитальдары толық болады, яғни олардың әр қайсысына екі электрон сәйкес келеді. Барлық толтырылған орбитальдардың ең жоғарғысы байланыстырмайтын n-орбиталь.
-орбитальдар және О атомының электронының бөлінбеген жұбы түзетін екі байланыстырмайтын n-орбитальдары болады. Молекуланың негізгі электрондық күйінде барлық байланыстыратын және байланыстырмайтын орбитальдары толық болады, яғни олардың әр қайсысына екі электрон сәйкес келеді. Барлық толтырылған орбитальдардың ең жоғарғысы байланыстырмайтын n-орбиталь.
Электрондық ауысулар байқалатын электр магниттік спектрлердің оптикалық облысын келесі диапазондарға бөледі: жақын ИҚ-облыс (1200 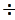 750 нм); көрінетін облыс (750
750 нм); көрінетін облыс (750 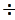 390 нм); жақын УК-облыс (390
390 нм); жақын УК-облыс (390 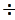 240 нм); алыс УК-облыс (240
240 нм); алыс УК-облыс (240 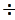 180 нм); вакуумдық УК-облыс (180
180 нм); вакуумдық УК-облыс (180 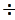 90 нм). Соңғысының вакуумдық аталу себебі толқын ұзындығы 180 нм төмен болған кезде атмосфералық оттегі сәуле жұта бастайды, ал 160 нм төмен болған кезде азот жұтады, сондықтан осындай диапазонда зерттеу жұмыстарын жүргізу үшін арнайы вакуумдық спектрометрлер қолданылады.
90 нм). Соңғысының вакуумдық аталу себебі толқын ұзындығы 180 нм төмен болған кезде атмосфералық оттегі сәуле жұта бастайды, ал 160 нм төмен болған кезде азот жұтады, сондықтан осындай диапазонда зерттеу жұмыстарын жүргізу үшін арнайы вакуумдық спектрометрлер қолданылады.
Электрондық ауысулардың бірнеше түрі бар. Негізгі күйдегі байланыстыратын орбитальдан энергиясы жоғары бос (қопсытқыш) орбитальға ауысуы мүмкін: 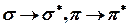 .
. 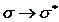 ауысулары көбіне вакуумдық УК-облыста байқалады.
ауысулары көбіне вакуумдық УК-облыста байқалады. 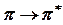 ауысулары 180 нм және жоғары ұзындықта байқалады; спектрлерде оларды К-жолақтар деп атайды, олар жұту интенсивтілігінің жоғары болуымен ерекшеленеді.
ауысулары 180 нм және жоғары ұзындықта байқалады; спектрлерде оларды К-жолақтар деп атайды, олар жұту интенсивтілігінің жоғары болуымен ерекшеленеді. 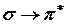 және
және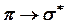 ауысуларының жолақтары қарапайым спектрометрлердің жұмысшы диапазонынан тысқары жатқан алыс УК-облыста орналасады.
ауысуларының жолақтары қарапайым спектрометрлердің жұмысшы диапазонынан тысқары жатқан алыс УК-облыста орналасады.
Байланыстырмайтын орбитальдардан энергиясы жоғары бос (қопсытқыш) орбитальға ауысулар болуы мүмкін, яғни 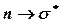 және
және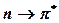 ауысулар.
ауысулар. 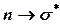 ауысуларының жолақтары жұту интенсивтілігінің орташа мәніне ие болады және алыс (кейде - жақын) УК-облыста байқалады.
ауысуларының жолақтары жұту интенсивтілігінің орташа мәніне ие болады және алыс (кейде - жақын) УК-облыста байқалады. 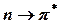 ауысуларына рұқсат етілмейді, оларды спектрдің жақын УК- және көрінетін облыстарында бақылауға болады; сәйкес жолақтардың интенсивтілігі әлсіз болады және оларды көбіне R-жолақтар деп атайды. Вакуумдық УК-облыста негізгі күйдегі орбитальдардан молекулалық иондардың түзілуіне алып келетін, энергиясы жоғары орбитальдардың біріне ауысуына сәйкес келетін жолақтар байқалады.
ауысуларына рұқсат етілмейді, оларды спектрдің жақын УК- және көрінетін облыстарында бақылауға болады; сәйкес жолақтардың интенсивтілігі әлсіз болады және оларды көбіне R-жолақтар деп атайды. Вакуумдық УК-облыста негізгі күйдегі орбитальдардан молекулалық иондардың түзілуіне алып келетін, энергиясы жоғары орбитальдардың біріне ауысуына сәйкес келетін жолақтар байқалады.
Спектрдің жақын УК- және көрінетін облыстарында жұтылуы, сонымен, молекуладағы қанықпаған байланыстар мен бөлінбеген электрон жұбы бар атомдардың болуымен түсіндіріледі. Осындай жұтылуға алып келетін атомдар тобы хромофорлар деп аталады. Құрамында бірдей хромофорлары бар бірқатар белгілі қосылыстар үшін спектрдегі орналасу жағдайы мен интенсивтілігі шамамен бірдей болатын сипаттамалық жолақтар байқалатыны тәжірибе түрінде дәлелденді. Мысалы, карбонилды хромофорлар үшін >C=O деңгейлер жүйесі ұқсас болады, яғни құрамына формальдегид молекуласындағыдай 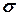 -,
-, 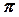 -,
-, 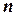 -,
-, 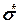 - және
- және 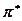 -орбитальдар енеді, бірақ әр түрлі қосылыстар молекуласы үшін дәл сәйкестік болмайды. 1-кестеде кейбір қарапайым хромофорлардың спектрлік сипаттамалары келтірілген.
-орбитальдар енеді, бірақ әр түрлі қосылыстар молекуласы үшін дәл сәйкестік болмайды. 1-кестеде кейбір қарапайым хромофорлардың спектрлік сипаттамалары келтірілген.
1-кесте. Кейбір қарапайым хромофорлардың жұтылу жолақтарының максимумдарының орналасуы
| Хромофор | Қосылыс | 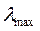 , нм , нм
|
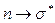 ауысулар ауысулар
| ||
| –Cl | CH3Cl | |
| –Br | CH3Br | |
| –I | CH3I | |
  –N
–N
| CH3NH2 | |
| –O– | CH3OH | |
| –S– | (CH3)2S 1 | |
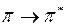 ауысулар ауысулар
| ||
| С=С | R2C=CHR | 173-189 |
| СºС | RCºCR 1 | 187-191 |
| С=С=С | C2H5CH=С=СH2 | |
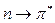 ауысулар ауысулар
| ||
| C=O | CH3CHO 1 | |
| N=O | трет-С4H9NO 2 | |
| N=N | CH3N=NCH3 3 | |
| C=S | CH2(CH2)4C=S |
1н-гександағы немесе циклогександағы ерітінді. 2(С2Н5)2О-та ерітілген ерітінді. 3С2Н5ОН-та ерітілген ерітінді. Қалғаны газ тәріздес күйде қарастырылады.
 - және
- және 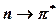 -жолақтарын эмпирикалық идентификациялау әдісі заттардың әр түрлі еріткіштерде еріген кездегі мінез-құлқына негізделген.
-жолақтарын эмпирикалық идентификациялау әдісі заттардың әр түрлі еріткіштерде еріген кездегі мінез-құлқына негізделген. 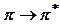 ауысулар үшін еріткіштің полярлығының өсуімен К-жолақтар толқынның ұзын жағына қарай ығысады (кейбір ароматтық молекулалар үшін жұтылудың К-жолағы кері қарай ығысады). Жұтылу жолағының толқынның ұзын бөлігіне қарай ығысуын батохромдық ығысу деп атаса, толқынның қысқа жағына ығысуы – гипсохромдық ығысу деп аталады.
ауысулар үшін еріткіштің полярлығының өсуімен К-жолақтар толқынның ұзын жағына қарай ығысады (кейбір ароматтық молекулалар үшін жұтылудың К-жолағы кері қарай ығысады). Жұтылу жолағының толқынның ұзын бөлігіне қарай ығысуын батохромдық ығысу деп атаса, толқынның қысқа жағына ығысуы – гипсохромдық ығысу деп аталады.
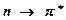 ауысулар үшін еріткіштің полярлығын арттырғанда жұтылудың R-жолақтарына сәйкес келетін гипсохромдық ығысу байқалады, сонымен қатар ығысудың шамасы К-жолақтарына қарағанда көп үлкен болады. Осындай ауысуларға жататын 270
ауысулар үшін еріткіштің полярлығын арттырғанда жұтылудың R-жолақтарына сәйкес келетін гипсохромдық ығысу байқалады, сонымен қатар ығысудың шамасы К-жолақтарына қарағанда көп үлкен болады. Осындай ауысуларға жататын 270 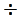 300 нм облысындағы әлсіз жолақ алифаттық альдегидтер мен кетондарға сәйкес келеді. Осы жолақтың орналасуы еріткіштің полярлығына да, карбонилды топтың ішкі молекулалық қоршауына да тәуелді болады. Мысалы, гександа ерітілген ацетонның жұтылу жолағының максимумы 279 нм толқын ұзындығында табылса, суда ерігендегі максимумы 264,5 нм ұзындықта байқалады. Сол сияқты, гександа ерітілген ацетальдегид®ацетон ®сірке қышқылының хлорангидриді қосылыстарының қатарында, яғни орынбасарының электр терістілігінің өсуіне қарай, жұтылу жолағының максимумы 293,4; 279,0; 235,0 нм ұзындықтарда байқалады және осы қатарда интенсивтіліктің артқанын көруге болады.
300 нм облысындағы әлсіз жолақ алифаттық альдегидтер мен кетондарға сәйкес келеді. Осы жолақтың орналасуы еріткіштің полярлығына да, карбонилды топтың ішкі молекулалық қоршауына да тәуелді болады. Мысалы, гександа ерітілген ацетонның жұтылу жолағының максимумы 279 нм толқын ұзындығында табылса, суда ерігендегі максимумы 264,5 нм ұзындықта байқалады. Сол сияқты, гександа ерітілген ацетальдегид®ацетон ®сірке қышқылының хлорангидриді қосылыстарының қатарында, яғни орынбасарының электр терістілігінің өсуіне қарай, жұтылу жолағының максимумы 293,4; 279,0; 235,0 нм ұзындықтарда байқалады және осы қатарда интенсивтіліктің артқанын көруге болады.
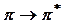 ауысу жолақтарының қарапайым батохромдық ығысуы молекуладағы электрон қозғалысының еркіндігін арттыратын еріткішпен әсерлесуімен байланысты. 3-кестеден көрініп тұрғандай, галогеналкилдардың батохромдық ығысуы галогеннің электрондық бұлтшалрдың полярлану дәрежесінің өсуімен артып отырады. Бірақ
ауысу жолақтарының қарапайым батохромдық ығысуы молекуладағы электрон қозғалысының еркіндігін арттыратын еріткішпен әсерлесуімен байланысты. 3-кестеден көрініп тұрғандай, галогеналкилдардың батохромдық ығысуы галогеннің электрондық бұлтшалрдың полярлану дәрежесінің өсуімен артып отырады. Бірақ 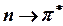 ауысуларда бөлінбеген жұп тұрақтанады, яғни негізгі электрондық күйдегі n-орбиталь сольваттану немесе еріткіштің молекуласымен сутектік байланыс түзу арқылы төмендейді. Молекула аралық байланыс неғұрлым күшті болса, күйлер энергиясының айырымы
ауысуларда бөлінбеген жұп тұрақтанады, яғни негізгі электрондық күйдегі n-орбиталь сольваттану немесе еріткіштің молекуласымен сутектік байланыс түзу арқылы төмендейді. Молекула аралық байланыс неғұрлым күшті болса, күйлер энергиясының айырымы 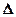 Е соғұрлым үлкен және n-орбитальдан бос (қопсытқыш) орбитальға ауысу жиілігі соғұрлым жоғары болады.
Е соғұрлым үлкен және n-орбитальдан бос (қопсытқыш) орбитальға ауысу жиілігі соғұрлым жоғары болады.
Молекуланың құрылымындағы хромофорларды жекешеленген және қосарланған деп бөлінеді. Жекешеленген хромофорлардың С=C, C=O, N=N, N=O сияқты бір ғана қос байланысы болады. Қосарланған хромофорларға қосарланған қысқа байланысы бар құрылымдық элементтер жатады. Молекулада қосарланған хромофорлардың көп мөлшерде жинақталуы олардың жұтылу интенсивтілігінің артуына және жолақтардың ұзын толқынды облысқа (шамамен әрбір енгізілетін С=С байланысы бойынша 30-40 нм) ығысуына алып келеді. Егер молекулада бірнеше хромофорлар болса, онда олар спектрдің өзгеруіне әсерін тигізеді. Бірақ хромофорлар тура байланысқан кезде ғана қатты ығысулар байқалады. Екі хромофордың ортасында метилен тобының болуы хромофорлардың бір-біріне әсерін әлсіретеді, ал егер хромофорлар екі немесе одан да көп метилен тобымен бөлінсе, онда қосарлану жоғалады. Ол кезде спектр құрамында жеке хромофорлары бар молекула спектрлерінің аддитивті суммасы түрінде болады.
Молекуланың химиялық құрылымында болатын өзгерістер және хромофор топтарының қосарлануы электрон спектрлерінің өзгеруімен бейнеленеді, осыған байланысты молекула құрылымы туралы бағалы ақпарат алуға болады. Бірақ мұндай ақпараттар үлкен қиындықпен алынады. Ерітіндідегі молекулалар үшін УК-облыста жазылған жұтылу шыңдарының ені кең болады (бірнеше ондық нанометр), сондықтан спектрлер сол облыста жұтатын қоспалардың әсерінен бұзылып түседі. Сонымен қатар, 3-кестеден көрініп тұрғандай, УК-облыста жұтылудың спецификасы төмен болады, яғни көптеген хромофорлардың жұтылу жолақтары бір-бірін жауып кетеді.
Электрондық спектроскопияда заряд алмастыратын (ЗА) ауысулар қарастырылады. Мұндай ауысуларға молекуланың бір бөлігінде жинақталған орбиталінен электрондардың басқа бөлігінде жинақталған орбиталіне ауысулары жатады. Молекула ішінде заряд (МЗА) алмасатын және комплекс ішінде заряд алмасатын (КЗА) ауысулар болып екіге бөлінеді. МЗА ауысулар ClO4-, SO42-, MnO4-, CrO42- және т.б. иондарда байқалады. Электрон оттегінің байланыстырмайтын орбиталінен (немесе байланыстыратын 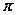 -орбиталінен), мысалы, қозған электрондық күйдегі Мn немесе Сr орбиталіне ауысып, металға дейін тотықсыздандырады. КЗА ауысуларда екі химиялық бөлшектер немесе молекулалар бір бүтін бөлшекті береді, яғни электрон әсерлесетін молекулалардың бірінің орбиталінен екіншісінің орбиталіне ауысатын кешен немесе жаңа бөлшек пайда болады. КЗА ауысулары, мысалы, ML6 типтес ауыспалы металдардың октаэдрлік кешендеріне сәйкес келеді (М – металл, L – лиганд). Электрон лигандтың толыққан
-орбиталінен), мысалы, қозған электрондық күйдегі Мn немесе Сr орбиталіне ауысып, металға дейін тотықсыздандырады. КЗА ауысуларда екі химиялық бөлшектер немесе молекулалар бір бүтін бөлшекті береді, яғни электрон әсерлесетін молекулалардың бірінің орбиталінен екіншісінің орбиталіне ауысатын кешен немесе жаңа бөлшек пайда болады. КЗА ауысулары, мысалы, ML6 типтес ауыспалы металдардың октаэдрлік кешендеріне сәйкес келеді (М – металл, L – лиганд). Электрон лигандтың толыққан  -орбиталінен (немесе
-орбиталінен (немесе 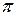 -орбиталінен) металдың бос d-орбиталіне ауысуы мүмкін (L®M-ауысулар). Кейбір лигандтар үшін M ® L типтес КЗА ауысулар болуы мүмкін, ал мұндай кешендердегі металдардың байланыстыратын және бос (қопсытқыш) d-орбитальдары арасындағы жиілігі төмен және интенсивтілігі аз ауысулары (көрінетін облыста) d-d-ауысулар болып табылады. Заряд алмастыратын ауысуларға сәйкес келетін жолақтар жоғарғы интенсивтілікпен сипатталады.
-орбиталінен) металдың бос d-орбиталіне ауысуы мүмкін (L®M-ауысулар). Кейбір лигандтар үшін M ® L типтес КЗА ауысулар болуы мүмкін, ал мұндай кешендердегі металдардың байланыстыратын және бос (қопсытқыш) d-орбитальдары арасындағы жиілігі төмен және интенсивтілігі аз ауысулары (көрінетін облыста) d-d-ауысулар болып табылады. Заряд алмастыратын ауысуларға сәйкес келетін жолақтар жоғарғы интенсивтілікпен сипатталады.
Дата добавления: 2016-03-22; просмотров: 3626;
