Тербелмелі спектроскопияның теориялық негіздері
Молекулалардың тербелмелі спектрлері практика жүзінде инфрақызыл (ИҚ) спектроскопиясы және ЖКШ спектроскопиясы әдістерімен зерттеледі. Таза тербелмелі спектрлер болмайды, себебі негізгі және қозған күйдегі молекулалар айналмалы күйдің қатарларында тарала орналасады. Молекулалар бір тербелмелі күйден екінші тербелмелі күйге ауысқан мезетте олардың айналу күйі де өзгереді, яғни үнемі тербелмелі-айналмалы спектрлер байқалады. Әрбір тербелмелі күйдің өзіне сәйкес (күрделі) айналу күйлерінің жиынтығы болады. Сондықтан көп атомды молекулалардың тербелмелі-айналмалы спектрлерінің құрылымы өте күрделі болып келеді. Спектрлі аспаптардың айыру қабілеті нашар болғанда газ фазасындағы көп атомды молекулалардың айналымдық құрылымын табу мүмкін емес, сондықтан спектрде жалпақ сызық түріндегі жалпы контуры байқалады. Конденсацияланған фазада сызықтың жылжуына және кеңеюіне алып келетін күшті молекула аралық әсерлесудің әсерінен спектрдегі айналу құрылымы болмайды.
Энергия диапазоны бойынша тербелмелі ауысулар толқын ұзындығы 0,7 мен 1000 мкм арасындағы ИҚ-диапазонның электр магнитті сәулесіне түседі. ИҚ-спектроскопия резонансты толқын ұзындығы бар жарық жұтатын спектрлерді зерттейді, осы спектрлер бойынша сандық талдау жарық жұту заңына негізделеді. Бугер-Ламберт-Бер заңының біріккен түрі келесі теңдеумен бейнеленеді:
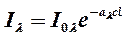 (4.1)
(4.1)
мұндағы 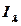 –
– 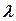 толқын ұзындығы бар зерттелетін заттан өткен сәуленің интенсивтілігі;
толқын ұзындығы бар зерттелетін заттан өткен сәуленің интенсивтілігі; 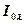 –
– 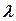 толқын ұзындығы бар зерттелетін затқа енген сәуленің интенсивтілігі;
толқын ұзындығы бар зерттелетін затқа енген сәуленің интенсивтілігі; 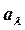 –
– 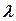 толқын ұзындығы үшін жұтылу коэффициенті,
толқын ұзындығы үшін жұтылу коэффициенті, 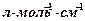 ; с – жұтатын қабаттағы заттың концентрациясы,
; с – жұтатын қабаттағы заттың концентрациясы, 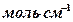 ;
;  – жұтатын қабаттың қалыңдығы,
– жұтатын қабаттың қалыңдығы, 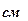 .
.
Ондық логарифм түріне ((1.9) қараңыз) өтіп және 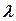 төменгі индексті ескермесек, келесі теңдеуге ие боламыз:
төменгі индексті ескермесек, келесі теңдеуге ие боламыз:
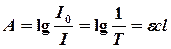 (4.2)
(4.2)
мұндағы А– оптикалық тығыздық немесе сөну; 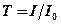 – өткізу немесе мөлдірлік (көбінесе
– өткізу немесе мөлдірлік (көбінесе 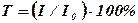 түрінде бейнеленеді);
түрінде бейнеленеді);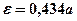 - сөндіру немесе экстинкция коэффициенті (кейде оны жұтылудың молекулалық немесе молярлық коэффициенті деп атайды).
- сөндіру немесе экстинкция коэффициенті (кейде оны жұтылудың молекулалық немесе молярлық коэффициенті деп атайды). 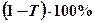 шамасын жұтылу пайызы (проценті) деп атайды. Интегралды интенсивтілік (жұтылудың) жолақтың ауданына тең, және, егер координаталар ретінде
шамасын жұтылу пайызы (проценті) деп атайды. Интегралды интенсивтілік (жұтылудың) жолақтың ауданына тең, және, егер координаталар ретінде 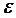 және
және 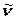 алынса, онда о онда осы интенсивтілік келесі интегралмен бейнеленеді:
алынса, онда о онда осы интенсивтілік келесі интегралмен бейнеленеді: 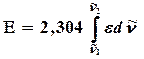 . Көптеген ИҚ-спектрометрлерде тіркелген спектрлер Т өткізудің (пайызбен көрсетілген) толқын санына
. Көптеген ИҚ-спектрометрлерде тіркелген спектрлер Т өткізудің (пайызбен көрсетілген) толқын санына 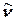 тәуелділігін береді.
тәуелділігін береді.
Тербелмелі спектрлер теориясы жақсы дамыған. Спектрлердің құрылымын зерттегенде және спектрлерді қатаң жіктегеде теорияны білу өте маңызды, бірақ тербелмелі спектроскопияны аналитикалық мақсатта пайдаланған кезде де оның теориялық негіздерін түсіне білу қажет.
Молекуланың тербелмелі энергиялық деңгейлерін сәйкес келетін кванттық-механикалық есептерді шешу арқылы алуға болады. Молекуланың күйі ядролар мен электрондардан тұратын біртұтас жүйе деп қарастырылып, толық толқындық функциямен бейнеленеді. Бірақ, массалардың ерекшелігін және электрондар мен ядролардың қозғалғыштығын ескеретін Борн-Оппенгеймер жақындастыруында электрондық және ядролық қозғалыстар жақсы дәлдікпен бөлінуі мүмкін. Жақындастырулар бойынша молекуланың ядролық каркасының тербелмелі және айналмалы қозғалыстарын да бөлуге болады, сол кезде үш түрге арналған Шредингердің толқындық теңдеуі жеке-жеке шешіледі, сөйтіп молекуланың толық энергиясын құрайтын электронды, тербелмелі және айналмалы күйлерінің энергияларын табуға мүмкіндік туады.
Бұл оқулықта тек тербелмелі деңгейді шешудің нәтижесін ғана қарастырамыз. Бұл үшін тек ядролардың салыстырмалы ығысуын ғана бейнелейтін координаталар енгізу қажет. Молекуланың үдемелі (поступательное) қозғалысы массалар орталығының қозғалысын сипаттайтын үш координатамен, айналмалы қозғалысы – Эйлер бұрышымен сипатталатын және басталуы массалар орталығында жататын координатаның сыртқы жүйесіне қатысты молекулалардың бағытталуын бейнелейтін үш координатамен сипатталады. Екі атомды молекулаларда бір ғана тербелмелі еркіндік дәрежесі болады, яғни тербелмелі толқындық функция қатысты болатын ядро аралық қашықтықтың өзгерісін бейнелейтін 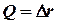 бір-ақ координата болады. Сонымен, N-атомды молекуланың тербелмелі қозғалысын қарастыру Qk координатының әрбір мәні ядролардың ығысуының кез-келген негізгі тербелмелі күйдің біріндегі тепе-тең жағдайына қатысты сипатталатын n=3N-6 енгізу қажет (сызықты молекула үшін 3N-5енгізіледі). Бұлар, басқаша айтқанда, нормальды координаталар (дәлірек айтсақ, нормальды координаталар молекулалардың тепе-тең геометриялық параметрлерінің өзгерістерінің сызықты комбинациясын – оның координаталардың декарттық жүйесіндегі тепе-тең күйінің ішкі координаталарға қатынасын түсіндіреді).
бір-ақ координата болады. Сонымен, N-атомды молекуланың тербелмелі қозғалысын қарастыру Qk координатының әрбір мәні ядролардың ығысуының кез-келген негізгі тербелмелі күйдің біріндегі тепе-тең жағдайына қатысты сипатталатын n=3N-6 енгізу қажет (сызықты молекула үшін 3N-5енгізіледі). Бұлар, басқаша айтқанда, нормальды координаталар (дәлірек айтсақ, нормальды координаталар молекулалардың тепе-тең геометриялық параметрлерінің өзгерістерінің сызықты комбинациясын – оның координаталардың декарттық жүйесіндегі тепе-тең күйінің ішкі координаталарға қатынасын түсіндіреді).
Нормальды координаталарды гармониялық жақындастыруда қолданғанда гармониялық осцилляторға арналған Шредингердің теңдеуі алынады, оның шешуі қарастырылған болатын. Оның энергиясының өзіндік мәндері:
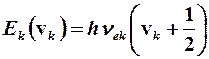 (4.3)
(4.3)
мұндағы vk = 1, 2, 3, … – тербелмелі квант саны; vek– тербеліс тұрақтысы. Екі атомды молекулалар үшін 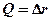 деп қабылдап, k индексін ескермеуге болады, ал тұрақты мән
деп қабылдап, k индексін ескермеуге болады, ал тұрақты мән 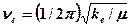 , яғни гармониялық тербелістердің классикалық жиілігіне арналған көрініске сәйкес келеді. Мұндағы
, яғни гармониялық тербелістердің классикалық жиілігіне арналған көрініске сәйкес келеді. Мұндағы 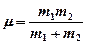 – ядроларының массасы m1 және m2 болатын екі атомды молекуланың келтірілген массасы; ke - гармониялық күш тұрақтысы, ол тепе-теңдік нүктесіндегі потенциалдық энергияның функциясының екінші туындысын түсіндіреді, яғни
– ядроларының массасы m1 және m2 болатын екі атомды молекуланың келтірілген массасы; ke - гармониялық күш тұрақтысы, ол тепе-теңдік нүктесіндегі потенциалдық энергияның функциясының екінші туындысын түсіндіреді, яғни 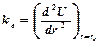 немесе
немесе 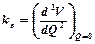 . Реалды екі атомды молекулаға арналған U потенциалды қисық шамамен Морзе функциясымен аппроксимацияланады:
. Реалды екі атомды молекулаға арналған U потенциалды қисық шамамен Морзе функциясымен аппроксимацияланады:
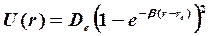 (4.4)
(4.4)
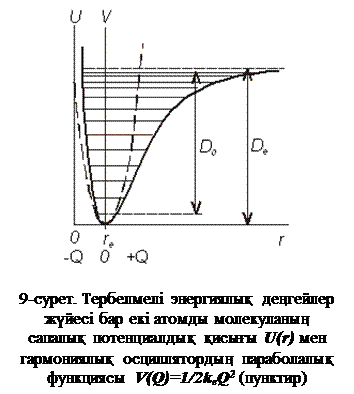
мұндағы De және 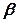 – тұрақтылар. Гармониялық осциллятордың параболалық функциясымен бірге осы функция 1-суретте көрсетілген.
– тұрақтылар. Гармониялық осциллятордың параболалық функциясымен бірге осы функция 1-суретте көрсетілген.
 Көп атомды молекулада белгілі энергиясы бар тербелмелі күйлердің жиынтығы болады. Энергиялар барлық 3N-6 (немесе 3N-5) тербелмелі нормальды координата-ларға тәуелді, тербелмелі толқындық функциямен сипатталатын vk тербелмелі квант санының n мөлшеріне тәуелді. Молекулалар, бірақ, кванттық механика заңына бағына отырып, олардың сипаттамаларының кейбір аспектілері (олардың ядро каркастарының тербелістері) классикалық жақындастыруларда да жақсы сипатталатындай жүйелерге қатысты болады. Аз тербелістердің классикалық теорияларының нәтижесіне сәйкес, көп атомды молекуланың кез-келген күрделі тербелістерін тербелістері нормальды болып саналатын гармониялық осцилляторлардың 3N-6 (немесе 3N-5) суперпозициясы ретінде қарастыруға болады. Анықтама бойынша мұндай тербелістер кезінде атомдардың барлық ығысулары бір ғана vk жиілікпен және белгілі фазада жүреді, ал әрбір дұрыс тербелістер бір Qk нормальды координатамен бейнеленеді. n гармониялық осцилляторлардан тұратын жүйе ретінде қарастырылатын көп атомды молекуланың тербелістерінің толық энергиясы олардың нормальды тербеліс энергияларының суммасына тең болады және (3.3) теңдеу бойынша есептеледі:
Көп атомды молекулада белгілі энергиясы бар тербелмелі күйлердің жиынтығы болады. Энергиялар барлық 3N-6 (немесе 3N-5) тербелмелі нормальды координата-ларға тәуелді, тербелмелі толқындық функциямен сипатталатын vk тербелмелі квант санының n мөлшеріне тәуелді. Молекулалар, бірақ, кванттық механика заңына бағына отырып, олардың сипаттамаларының кейбір аспектілері (олардың ядро каркастарының тербелістері) классикалық жақындастыруларда да жақсы сипатталатындай жүйелерге қатысты болады. Аз тербелістердің классикалық теорияларының нәтижесіне сәйкес, көп атомды молекуланың кез-келген күрделі тербелістерін тербелістері нормальды болып саналатын гармониялық осцилляторлардың 3N-6 (немесе 3N-5) суперпозициясы ретінде қарастыруға болады. Анықтама бойынша мұндай тербелістер кезінде атомдардың барлық ығысулары бір ғана vk жиілікпен және белгілі фазада жүреді, ал әрбір дұрыс тербелістер бір Qk нормальды координатамен бейнеленеді. n гармониялық осцилляторлардан тұратын жүйе ретінде қарастырылатын көп атомды молекуланың тербелістерінің толық энергиясы олардың нормальды тербеліс энергияларының суммасына тең болады және (3.3) теңдеу бойынша есептеледі:
Ev (V1, V2, V3, …,Vn)= 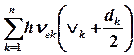 (4.5)
(4.5)
мұндағы dk – бір рет қана есептелетін тербелмелі күйдің туындалу дәрежесі (1, 2, 3 мәндеріне тең болады), яғни туындалу болған жағдайда n<3N-6 (немесе 3N-5). Туындалған күйлердің энергиялары бірдей болады, бірақ әр түрлі толқындық функциямен сипатталады, себебі координаталары – әр түрлі.
Сонымен, кез-келген молекула үшін тербелмелі күйдің серияларын беретін нормальды тербелістердің мөлшерін vk=0, 1, 2, 3… санауға болады. Айналмалы күйлерді ескермеген кезде де тербелмелі спектрдің бейнесі өте күрделі болады. Бірақ, біріншіден, жоғарғы квант саны бар деңгейлердің барлығы да болуы мүмкін емес, яғни диссоциацияланбаған молекулаларға барлығы сәйкес келмейді. Екіншіден, ауысулары с спектрдің зерттелетін облысында (ИҚ және КШ) жататын энергиялық диапазондағы деңгейлер маңызды болып табылады. Үшіншіден, осы диапазонға сәйкес келетін деңгейлер мен ауысулар практика жүзінде маңызды болып табылмайды, сондықтан оларды маңызды және екіншілік жіктерге бөлуге болады.
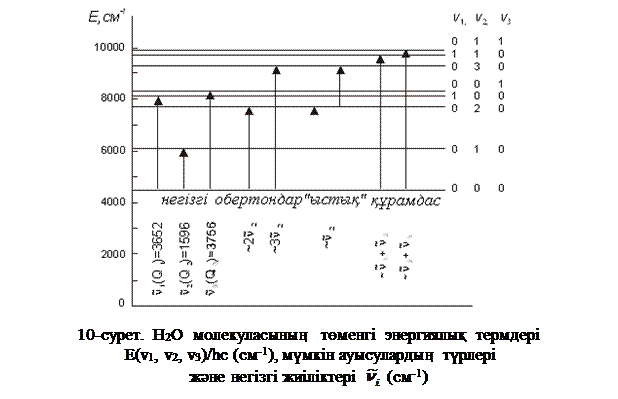
Заттың тербелмелі спектрі ИҚ-сәулелерін (немесе КШС) жұтқан кезде байқалады, себебі молекулалар hν фотондарымен әсерлескенде тербелу күйлері өзгереді, яғни молекулалар энергияның басқа деңгейлеріне ауысады. Арасында ауысулар жүретін күйлердің энергияларының айырымы Бор қатынасымен (K.1) анықталады, мұндағы 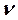 – жұтылатын сәуленің жиілігі. Мысал ретінде 10-суретте су молекуласы үшін өте төмен жатқан энергияның тербелмелі деңгейінің жүйесі көрсетілген (молекулалық спектроскопияда қабылданғандай, см-1 өлшеміндегі тербелмелі термдер түрінде келтірілген, олардың сандық мәні hc-ға бөлінген сәйкес энергиялардың мәндеріне тең болады). Рұқсат етілетін ауысулардың іріктеу ережесі арасында ауысулар жүретін күйлерді сипаттайтын толқындық функциялардың қасиетімен
– жұтылатын сәуленің жиілігі. Мысал ретінде 10-суретте су молекуласы үшін өте төмен жатқан энергияның тербелмелі деңгейінің жүйесі көрсетілген (молекулалық спектроскопияда қабылданғандай, см-1 өлшеміндегі тербелмелі термдер түрінде келтірілген, олардың сандық мәні hc-ға бөлінген сәйкес энергиялардың мәндеріне тең болады). Рұқсат етілетін ауысулардың іріктеу ережесі арасында ауысулар жүретін күйлерді сипаттайтын толқындық функциялардың қасиетімен 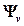 және өзіндік немесе келтірілген дипольдық моменттің кванттық-механикалық операторларымен анықталады. Жұтылудың ИҚ-спектрлерінде тек молекула зарядының электрлік орталығын ығыстыра жүретін тербелістер, яғни өзіндік дипольдық моменті өзгеретін тербелістер ғана оптикалық активті болып табылады (байқалады). ЖКШ спектрлерінде келтірілген (сәуле өрісінің полярлануы нәтижесінде) дипольдық моментінің өзгеруімен жүретін тербелістер байқалады. Сондықтан H2, N2, Cl2 симметриялық молекулалардың тербелістері КШ-спектрлерінде байқалады да, ИҚ-спектрлерінде көрінбейді.
және өзіндік немесе келтірілген дипольдық моменттің кванттық-механикалық операторларымен анықталады. Жұтылудың ИҚ-спектрлерінде тек молекула зарядының электрлік орталығын ығыстыра жүретін тербелістер, яғни өзіндік дипольдық моменті өзгеретін тербелістер ғана оптикалық активті болып табылады (байқалады). ЖКШ спектрлерінде келтірілген (сәуле өрісінің полярлануы нәтижесінде) дипольдық моментінің өзгеруімен жүретін тербелістер байқалады. Сондықтан H2, N2, Cl2 симметриялық молекулалардың тербелістері КШ-спектрлерінде байқалады да, ИҚ-спектрлерінде көрінбейді.
Толқындық функциялар симметриясын ескерген кездегі гармониялық осциллятор үшін кванттық-механикалық есептің шешімін табу үшін дипольды ауысулардың іріктеу ережесі: 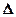 vk=1. Осындай іріктеу ережесі кезінде vk және vk+1 деңгейлер арасындағы ауысулардың жиілігі
vk=1. Осындай іріктеу ережесі кезінде vk және vk+1 деңгейлер арасындағы ауысулардың жиілігі 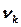 тербелу тұрақтысымен
тербелу тұрақтысымен 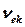 сәйкес келеді,яғни гармониялық тербелістің Qk нормальды координатасымен бейнеленетін классикалық жиілігімен сәйкес келеді.
сәйкес келеді,яғни гармониялық тербелістің Qk нормальды координатасымен бейнеленетін классикалық жиілігімен сәйкес келеді.
2-суретте су молекуласының тербелмелі термдер жүйесіндегі мүмкін болатын ауысулардың әр түрлері мен Н2О үшін сәйкес термдердің айырымы түрінде анықталатын негізгі ауысулардың толқындық сандары көрсетілген. Энергияның нолінші деңгейінен деңгейлердің бірі v=1(басқалары v=0) болатын деңгейге ауысуы негізгі ауысу деп аталады және спектрде негізгі немесе фундаменталдық жиіліктер береді. Энергияның нөлінші деңгейінен деңгейлердің бірі v=2, 3, …(басқалары v=0) болатын деңгейге ауысуы обертондық ауысу деп аталады және негізгі жиіліктердің (шамамен екі, үш еселенген және т.б. мәндері бар) әлсіз обертондар (біріншілік, екіншілік және т.б.) жолағын береді. Бірнеше v мәндері нольден ерекше болатын деңгейлерге ауысуды құрамдас немесе комбинацияланған ауысулар деп атайды және интенсивтілігі төмен құрамдас (комбинацияланған) жиіліктер береді. v деңгейлерінің біреуі (немесе бірнешеуі) v>0 болғанда, өте жоғары деңгейлерге ауысулар «ыстық» ауысулар деп аталады және спектрде «ыстық сызықтар» береді.
Бөлме температурасында молекулалардың 99% v=0болатын төменгі тербелмелі деңгейде орналасады, сондықтан ИҚ-сәулесін жұтқан кезде тек негізгі ауысулар ғана болу керек. Шынында, нақты молекулалар қатаң гармониялық тербелістерге бағынбайды, ал потенциалық энергияның қисығы 7-суретте көрсетілгендей Морзе функциясымен (3.4) дәлірек бейнеленеді. Ангармониялық осцилляторда энергиялық деңгейлер арасындағы қашықтық v-ның өсуімен азаяды, ал іріктеу ережесі бұзылуы мүмкін. Сондықтан нақты молекулаларда  v=2, 3…(обертондар) немесе бірнеше квант сандары бір мезгілде өзгерген кезде (құрамдас ауысулар) болатын басқа ауысулар болуы мүмкін, бірақ олардың интенсивтіліктері негізгі ауысулардың интенсивтілігінен әлсіз болады. Энергиясы төмен қозған деңгейлердің, мысалы, айналатын және басқа тербелістердің, толтырылуы (~300 см-1) жоғары болуы мүмкін, осыған сәйкес алыс ИҚ-облыстағы «ыстық» жолақтар бөлме температурасында да интенсивті болады, бірақ зерттелетін зат салқындатылған кезде олардың интенсивтілігі бірден төмендейді. Обертондар мен құрамдас жиіліктер аналитикалық мақсатта пайдалы болып табылады.
v=2, 3…(обертондар) немесе бірнеше квант сандары бір мезгілде өзгерген кезде (құрамдас ауысулар) болатын басқа ауысулар болуы мүмкін, бірақ олардың интенсивтіліктері негізгі ауысулардың интенсивтілігінен әлсіз болады. Энергиясы төмен қозған деңгейлердің, мысалы, айналатын және басқа тербелістердің, толтырылуы (~300 см-1) жоғары болуы мүмкін, осыған сәйкес алыс ИҚ-облыстағы «ыстық» жолақтар бөлме температурасында да интенсивті болады, бірақ зерттелетін зат салқындатылған кезде олардың интенсивтілігі бірден төмендейді. Обертондар мен құрамдас жиіліктер аналитикалық мақсатта пайдалы болып табылады.
Нормальды тербелістер симметрия түріне қарай жіктеледі, себебі атомдардың тепе-теңдік жағдайынан тек белгілі ығысулары ғана мүмкін бола алады. Қарапайым мысал ретінде үш атомды сызықты СО2 молекуласының тербелу формаларын келтіруге болады (3-сурет), бұл молекула үшін 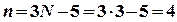 нормальды тербелістер болу керек. Суретте пунктир сызығымен қарсы фазаға ығысуы көрсетілген, ал тілдің бағыты тепе-теңдік жағдайынан ығысуын көрсетеді.
нормальды тербелістер болу керек. Суретте пунктир сызығымен қарсы фазаға ығысуы көрсетілген, ал тілдің бағыты тепе-теңдік жағдайынан ығысуын көрсетеді.
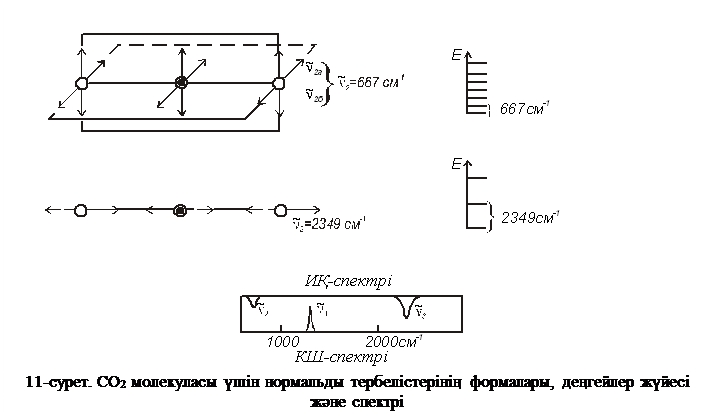
Үш атомды молекулалар үшін  тербелісін толық симметриялық немесе симметриялық валентті тербелістер
тербелісін толық симметриялық немесе симметриялық валентті тербелістер  деп атау қабылданған, себебі бұл тербелістер байланыстардың бір фазада созылуы арқылы жүреді және ядроларды байланыстыратын сызықтың бойымен қозғалады немесе соған жақын болады.
деп атау қабылданған, себебі бұл тербелістер байланыстардың бір фазада созылуы арқылы жүреді және ядроларды байланыстыратын сызықтың бойымен қозғалады немесе соған жақын болады.  тербелістері антисимметриялық валентті тербелістер
тербелістері антисимметриялық валентті тербелістер 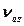 деп аталады (байланыстар фазадан тыс созылады);
деп аталады (байланыстар фазадан тыс созылады); 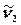 тербелістер деформациялық тербеліс деп аталады және
тербелістер деформациялық тербеліс деп аталады және 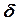 деп белгіленеді, себебі ол тербелістер байланыс арасындағы валенттік бұрышының өзгеруі арқылы жүреді және ядроларды байланыстыратын сызыққа перпендикуляр бағытталады. СО2 молекуласы үшін екі өзара перпендикуляр жазықтықтарда екі
деп белгіленеді, себебі ол тербелістер байланыс арасындағы валенттік бұрышының өзгеруі арқылы жүреді және ядроларды байланыстыратын сызыққа перпендикуляр бағытталады. СО2 молекуласы үшін екі өзара перпендикуляр жазықтықтарда екі 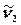 тербелістер болады. Осы тербелістер кеңістікте бағытталғаннан басқа жағдайлардың бәрінде бірдей болғандықтан, олардың жиіліктері де бірдей болу қажет, яғни деформациялық тербелістер екі рет туындалады. Сондықтан СО2 спектрінде эксперимент жүзінде төрт жиіліктің орнына үш жиілік байқалады, соның ішінде екеуі ИҚ спектрінде көрінсе, біреуі КШ спектрлерінде байқалады (11-суретті қараңыз). СО2 молекуласы орталық арқылы симетриялы болғандықтан өзіндік дипольдық моменті нольге тең болады және
тербелістер болады. Осы тербелістер кеңістікте бағытталғаннан басқа жағдайлардың бәрінде бірдей болғандықтан, олардың жиіліктері де бірдей болу қажет, яғни деформациялық тербелістер екі рет туындалады. Сондықтан СО2 спектрінде эксперимент жүзінде төрт жиіліктің орнына үш жиілік байқалады, соның ішінде екеуі ИҚ спектрінде көрінсе, біреуі КШ спектрлерінде байқалады (11-суретті қараңыз). СО2 молекуласы орталық арқылы симетриялы болғандықтан өзіндік дипольдық моменті нольге тең болады және 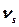 толық симметриялық тербелістер кезінде өзгермейді, яғни тербелістері ИҚ-спектрінде активті болмайды. Сонымен қатар осындай тербеліс кезінде СО2 молекуласының полярлануы тепе-теңдік нүктесінде экстремумнан өтпейді, яғни тербелістер КШ-спектрлерінде активті болады.
толық симметриялық тербелістер кезінде өзгермейді, яғни тербелістері ИҚ-спектрінде активті болмайды. Сонымен қатар осындай тербеліс кезінде СО2 молекуласының полярлануы тепе-теңдік нүктесінде экстремумнан өтпейді, яғни тербелістер КШ-спектрлерінде активті болады.
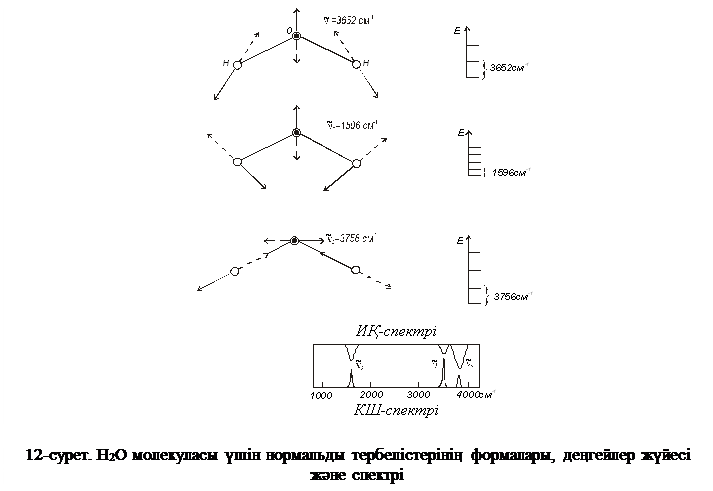
Жиіліктердің альтернативті тыйым салыну ережесі немесе бірін-бірі жою ережесі бар: симметрия орталығы бар барлық молекулаларда, симметриясы бойынша D4d, C5h, D5h, D6d нүктелік топтарға жататын молекулаларда нормальды тербелістер тек қана ИҚ-спектрінде немесе тек КШ-спектрінде активті емес немесе осы екі спектрлерде де активті бола алады, бірақ осы екі спектрлерде де бір мезгілде активті бола алмайды. Бірақ басқа молекулаларда бұл ереже орындалмайтынын айта кету қажет, сызықты емес молекулаларда тербелістердің бірде бір формасы тек таза валентті немесе таза деформациялық бола алмайды (су молекуласына арналған 12-суретті Н2О молекуласында барлық үш нормальды тербелістер (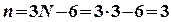 ) ИҚ-спектрлерінде де, КШ-спектрлерінде де активті болып табылады. Сонымен, XY2 молекулалары үшін молекула сызықты қараңыз). Немесе сызықты емес екендігін КШ және ИҚ спектрлерін салыстыру арқылы анықтауға болады.
) ИҚ-спектрлерінде де, КШ-спектрлерінде де активті болып табылады. Сонымен, XY2 молекулалары үшін молекула сызықты қараңыз). Немесе сызықты емес екендігін КШ және ИҚ спектрлерін салыстыру арқылы анықтауға болады.
ДӘРІС 5
Дата добавления: 2016-03-22; просмотров: 4528;
