Закон действующих масс для равновесий
Химическое равновесие характеризуется важным свойством, которое обозначается как закон действующих масс (для равновесий).
1. Выпишем соотношение (4.35):

Стандартная энергия Гиббса реакции — величина, не зависящая от концентраций участников (по той причине, что ее определяют всегда для одних и тех же — одномолярных — концентраций).
Следовательно, постоянна и константа равновесия Kp, что можно записать следующим образом:
 |

Символ 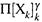 — это произведение равновесных концентраций соответствующих веществ (продуктов либо реагентов), взятых в стехиометрических степенях.
— это произведение равновесных концентраций соответствующих веществ (продуктов либо реагентов), взятых в стехиометрических степенях.
2. Постоянство Kp значит, что независимо от исходных концентраций участников обратимой реакции (и реагентов, и продуктов), если реакция приходит к равновесному состоянию, отношение произведения конечных концентраций продуктов и реагентов оказывается всегда одним и тем же.
Это и есть закон действующих масс для равновесий. Часто его формулируют следующим образом: отношение равновесных концентраций продуктов и субстратов (где концентрации взяты в соответствующих стехиометрических степенях) не зависит от исходных концентраций участников.
В предыдущих курсах химии этот закон упоминался. Но сейчас мы пришли к нему термодинамическим путем— исходя из уравнения изотермы химической реакции.
Дата добавления: 2016-03-20; просмотров: 719;
