Энергия Гиббса химических реакций
Уточним, чтó следует понимать под энергией Гиббса химической реакции (так для краткости называют изменение энергии Гиббса в реакции, 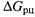 ).
).
1. а) Возьмем следующую обратимую реакцию (обратимую в химическом, а не в термодинамическом смысле):

Представим, что молярные концентрации всех участников (и реагентов, и продуктов) — произвольны и постоянны;их обозначим через 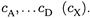
б) Но если дать реакции придти в равновесие, то концентрации изменились бы до равновесных значений, которые обозначим через [A],…[D] ([X]) ..
Таким образом, если 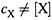 , то участник обладает некоторой энергией, которая равна энергии перехода
, то участник обладает некоторой энергией, которая равна энергии перехода 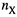 молей этого вещества от существующей концентрации к равновесной:
молей этого вещества от существующей концентрации к равновесной:

2. а) Рассматриваемую реакцию можно разбить на три стадии:

б) Используя (4.30), нетрудно записать энергию Гиббса каждой стадии:

в) Суммируя, получаем изменение энергии Гиббса в исходной реакции:

Перегруппировка логарифмов позволяет объединить в одном слагаемом равновесные, а в другом — действительные концентрации веществ:

откуда следует, что в первом слагаемом оказывается константа равновесияреакции — Кр, а во втором слагаемом — т.н. произведение концентрацийПс.
 |
3. В итоге получено уравнение изотермы реакции, которое еще называется уравнением Вант-Гоффа:
Выводы.
а) Во-первых, стало очевидно, чтó же понимают под величиной ΔGрц. Действительно, в результирующем уравнении реакции, следующем из представления (4.31), сохраняются исходные концентрации участников. Таким образом, ΔGрц (для прямой реакции) — это изменение энергии Гиббса в результате превращения стехиометрических количеств реагентов в стехиометрические количества продуктов при сохранении всех концентраций на исходном уровне(cA, cв, сс и сD).
б) Во-вторых, видно, что величина ΔGрц зависит от концентраций участников, и уравнение изотермы определяет конкретный вид этой зависимости.
Дата добавления: 2016-03-20; просмотров: 718;
