Химический потенциал
1. а) Как известно, в химических процессах меняется и количествотого или иного вещества. Поэтому энергия Гиббса системы в состоянии равновесия зависит также от количества ее компонентов:

Это означает, что выражение (4.19) следует расширить, добавляя члены, содержащие дифференциалы ni :

б) Множители μj при данных дифференциалах называются химическими потенциаламикомпонентов системы.
Очевидно, каждый такой множитель — это частная производная энергии Гиббса по количеству соответствующего вещества:
 |
2. а) Если условия являются изотермо-изобарными (т.е. когда dP = dT = 0), выражение (4.21,б) сводится к сумме парциальных энергий Гиббса, относящихся к отдельным химическим компонентам системы:

б) Отсюда вытекает простая интерпретация химического потенциала того или иного компонента. По существу, μj— это та часть энергии Гиббса системы, которая приходится на 1 моль данного вещества, т. е. это просто энергия Гиббса 1 моля вещества.
 |
в) Следовательно, для изотермо-изобарных процессов химический потенциал компонента системы можно отождествлять с его молярной энергией Гиббса, а так как зависимость Gj от числа молей — линейная, то можно просто написать:
3. Соответственно, для изотермо-изохорного процесса

т. е. здесь 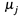 — это энергия Гельмгольца 1 моля вещества.
— это энергия Гельмгольца 1 моля вещества.
Вышесказанное применимо и к физическим, и к химическим процессам. Далее же будет рассмотрена энергия Гиббса преимущественно химических систем, для которых мы получим ряд полезных соотношений.
Однако предварительно необходимо остановиться на осмотических процессах, поскольку химическую систему можно представить как совокупность осмотических систем.
Дата добавления: 2016-03-20; просмотров: 773;
