Осмотические процессы
1. а) В осмотическом процессе все изменение системы состоит в изменении концентрации растворенного вещества.
б) В п. 3.4 отмечалось, что в таком процессе (в изотермических условиях) теплота не поглощается и не выделяется. Как там было сказано, разбавление раствора эквивалентно расширению газа в пустоту, а при таком расширении работа против давления не совершается, отчего не требуется и поглощение теплоты.
в) Итак, первое слагаемое энергии Гиббса равно нулю, и все изменение этой энергии обусловлено только изменением энтропии системы:

г) В том же п. 3.4 указано, что изменение энтропии в таких процессах рассчитывается (при не очень больших концентрациях) по формуле:

 |
д) Подставляя это выражение в (4.26, б), получаем и формулу для расчета энергии Гиббса:
2. а) Обе эти формулы имеют строго определенную область применимости и относятся к переходу п молей вещества от концентрации 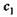 к концентрации
к концентрации 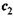 .
.
Указанный переход может совершаться в следующих случаях:
I. при разбавлении или концентрировании вещества путем изменения
содержания растворителя,
II. в ходе переноса вещества через границу, разделяющую две среды сразными и постоянными концентрациями этого вещества (рис. 4.2).
 б) Второй случай особо важен для биологических объектов — это, по существу, трансмембранный транспорт веществ. А чтобы концентрации в отсеках оставались постоянными, отсеки надо считать неограниченными. При этом совокупность растворенного вещества в обоих отсеках — закрытая система, так что критерием самопроизвольности переноса веществ через границу, действительно, является энергия Гиббса (при Т и Р – const).
б) Второй случай особо важен для биологических объектов — это, по существу, трансмембранный транспорт веществ. А чтобы концентрации в отсеках оставались постоянными, отсеки надо считать неограниченными. При этом совокупность растворенного вещества в обоих отсеках — закрытая система, так что критерием самопроизвольности переноса веществ через границу, действительно, является энергия Гиббса (при Т и Р – const).
3. Формула (4.27) показывает:

т.е. самопроизвольным может быть только переход вещества от состояния с большей концентрацией в состояние с меньшей концентрацией.
Дата добавления: 2016-03-20; просмотров: 779;
