Описание и растворимость. Белый аморфный или мелкокристаллический порошок, без запаха
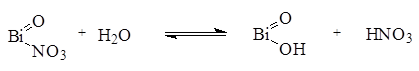
Белый аморфный или мелкокристаллический порошок, без запаха. Практически нерастворим в воде и спирте. Легко растворим в разведенных минеральных кислотах – азотной, хлороводородной, серной. Порошок, смоченный водой, окрашивает синюю лакмусовую бумагу в красный цвет, так как при гидролизе вещества выделяется кислота азотная:
Подлинность
Для проведения реакций подлинности ЛВ растворяют в разбавленной кислоте хлороводородной или серной:
ЛВ + 3HCl BiCl3 + 3H+
1. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
Bi3+ + 3NaOH Bi(OH)3 + 3Na+
Образуется белый осадок висмута гидроксида, нерастворимый в избытке реактива и растворимый в минеральных кислотах.
2. Реакция осаждения раствором натрия сульфида:
2Bi3+ + 3Na2S Bi2S3 + 6Na+
Коричнево-черный
осадок
Осадок висмута сульфида нерастворим в минеральных кислотах.
3. Реакция осаждения и комплексообразования с раствором калия йодида.
Ион висмута с раствором калия йодида образует черный осадок висмута йодида:
Bi3+ + 3KI BiI3 + 3K+
2 капли Черный осадок
Осадок растворяется в избытке реактива с образованием желто-оранжевого раствора комплексного соединения – калия тетрайодвисмутата (III):
BiI3 + KI K[BiI4]
Избыток Желто-оранжевое окрашивание
4. При прокаливании ЛВ образуется остаток ярко-желтого цвета и выделяются бурые пары азота (IV) оксида:
t 0
4BiO(NO3) 2Bi2O3 + 4NO2 + O2
Ярко-желтый Бурые
остаток пары
5. Доказательство нитрат-иона. Реакция с раствором дифениламина в кислоте серной концентрированной. Дифениламин окисляется нитратами до дифенилдифенохинондиимина гидросульфата, окрашенного в синий цвет (см. с. 10).
Чистота
1. Кислотность водного извлечения.
2. Потерю в массе при высушивании.
3. Предельное содержание примеси щелочных и щелочно-земельных металлов, карбонатов, хлоридов, сульфатов, солей аммония, мышьяка и теллура.
4. Отсутствие солей меди, свинца, серебра. ЛВ растворяют в кислоте азотной концентрированной, и полученный раствор разбавляют водой. В осадок выпадают основные соли висмута, которые отфильтровывают.
Если в ЛВ присутствуют примеси солей меди, свинца, серебра, они остаются в фильтрате в виде нитратов.
Катион меди (II) в фильтрате обнаруживают по реакции комплексообразования с раствором аммиака; раствор должен оставаться бесцветным:
Cu(NO3)2 + 4NH4OH [Cu(NH3)4](NO3)2 + 4H2O
Синее окрашивание
Катион свинца – по реакции осаждения кислотой серной; не должна появляться муть:
Pb(NO3)2 + H2SO4 PbSO4 + 2HNO3
Белый осадок
Катион серебра – по реакции осаждения кислотой хлороводородной; допускается опалесценция, не превышающая опалесценцию эталонного раствора:
AgNO3 + HCl AgCl + HNO3
Белый осадок
Дата добавления: 2016-03-20; просмотров: 1923;
