Распространение в природе. В природе чаще всего встречаются в виде сульфидов: ZnS – цинковая обманка; Bi2S3 – висмутовый блеск; Ag2S – серебряный блеск; CuFeS2 – медный колчедан
В природе чаще всего встречаются в виде сульфидов: ZnS – цинковая обманка; Bi2S3 – висмутовый блеск; Ag2S – серебряный блеск; CuFeS2 – медный колчедан, и в виде ряда других соединений, например, Bi2О3 – висмутовая охра, Al2O3 – корунд, Al2O3 n H2O – боксит, ZnCO3 – цинковый шпат и др.
Медицинское значение
ЛС данной группы соединений обладают широкой терапевтической активностью. Применяются в качестве антисептических, подсушивающих, вяжущих, прижигающих, противовоспалительных и антианемических средств.
Многие металлы являются необходимыми микроэлементами для жизнедеятельности организма и входят в состав ферментов. Железо и медь участвуют в окислительно-восстановительных реакциях в организме. Они необходимы для синтеза гемоглобина. Цинк регулирует иммунные и метаболические процессы.
СОЕДИНЕНИЯ ВИСМУТА
Висмута нитрат основной
Bismuthi subnitras
Химический состав висмута нитрата основного непостоянен. Представляет собой смесь основных солей висмута и небольших количеств висмута нитрата и висмута гидроксида.
Получение
Висмута нитрат основной получают окислением металлического висмута концентрированной азотной кислотой:
Bi + 4HNO3 Bi(NO3)3 + NO + 2H2O
Висмута нитрат гидролизуется с образованием смеси основных солей висмута:

Висмутила нитрат

Висмутила нитрата гидрат
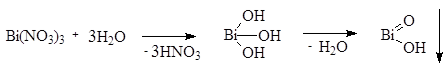
Висмутила гидроксид
Основные соли адсорбируют висмута нитрат Bi(NO3)3 и висмута гидроксид Bi(OH)3.
Дата добавления: 2016-03-20; просмотров: 2095;
