Количественное определение. Вначале проводят минерализацию колларгола и протаргола концентрированными серной и азотной кислотами при нагревании для переведения связанного серебра в
Вначале проводят минерализацию колларгола и протаргола концентрированными серной и азотной кислотами при нагревании для переведения связанного серебра в ионное состояние:
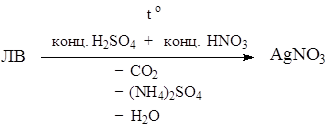
Затем образовавшиеся ионы серебра количественно определяют методом тиоцианометрии (см. с. 65).
Стандартизация ЛВ проводится по содержанию в них серебра.
fэкв.(Ag) = 1
Хранение
В хорошо укупоренных банках оранжевого стекла в защищенном от света месте, чтобы не допустить разложения с образованием ионов серебра (колларгол – по списку Б).
Применение
Наружно в качестве вяжущих, антисептических, противовоспалительных средств в виде водных растворов. Колларгол применяют также в виде мазей.
Формы выпуска
Субстанция.
СОЕДИНЕНИЯ ЖЕЛЕЗА (II)
Железа (II) сульфат Ferrous sulfate (МНН)
FeSO4 7H2O Ferri (II) sulfas(ЛН)
Получение
Растворением железа в растворе кислоты серной при нагревании:
Fe + H2SO4 FeSO4 + H2
Раствор упаривают до кристаллизации и полученный железа (II) сульфат сушат при 30 0С.
Описание
Прозрачные кристаллы светлого голубовато-зеленого цвета или кристаллический бледно-зеленый порошок. На воздухе выветривается. Легко растворим в воде, растворим в спирте. Водные растворы имеют слабо-кислую реакцию среды, т.к. железа (II) сульфат подвергается гидролизу с выделением кислоты серной:
2FeSO4 + H2O Fe2(OH)2SO4 + H2SO4
Подлинность
1. Реакция осаждения калия гексацианоферратом (III). Образуется синий осадок железа (II) гексацианоферрата (III) – турнбулева синь:
3FeSO4 + 2K3[Fe(CN)6] Fe3[Fe(CN)6]2 + 6KCl
Синий осадок
2. Реакция осаждения аммония сульфидом:
FeSO4 + (NH4)2S FeS + (NH4)2SO4
Черный осадок
Образуется черный осадок железа (II) сульфида, растворимый в кислоте хлороводородной.
3. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
FeSO4 + 2NaOH Fe(OH)2 + Na2SO4
Белый осадок
Образуется белый осадок железа (II) гидроксида, который на воздухе окисляется с образованием железа (III) гидроксида красно-коричневого цвета:
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Красно-коричневый осадок
4. Реакция на сульфат-ион – см. с. 44.
Дата добавления: 2016-03-20; просмотров: 3002;
