Бария сульфат для рентгеноскопии
Barium sulfate(МНН)
Barii sulfas pro rоentgeno (ЛН)
BaSO4
Получение
Из природных минералов: BaСO3 – витерита и BaSO4 – барита (тяжелого шпата). Природные минералы переводят в водорастворимую соль – бария хлорид:
BaСO3 + 2НСI → BaСI2 + CO2 + H2O
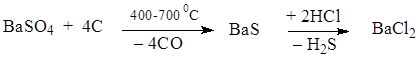
Для получения ЛВ в виде мелкодисперсного порошка раствор бария хлорида медленно вливают в раствор натрия сульфата в присутствии защитных коллоидов (отвар семян льна):
BaСI2 + Na2SO4 → BaSO4↓ + 2NaСI
Осадок бария сульфата тщательно отмывают от примесей исходных и промежуточных соединений бария.
Описание и растворимость
Белый, тонкий, рыхлый порошок без запаха, нерастворим в воде, практически нерастворим в разведенных кислотах, щелочах и органических растворителях.
Подлинность
Для проведения реакций подлинности необходимо перевести бария сульфат в растворимую в воде соль. С этой целью ЛВ кипятят с раствором натрия карбоната:
BaSO4↓ + Na2CO3 → BaCO3 + Na2SO4
Осадок бария карбоната отфильтровывают, и в фильтрате определяют сульфат-ион по реакции с бария хлоридом:
Na2SO4 + BaСI2 → BaSO4 + 2NaСI
Осадок на фильтре (бария карбонат) обрабатывают кислотой хлороводородной разведенной, фильтруют и в фильтрате определяют катион бария с кислотой серной разведенной:
BaCO3↓ + 2НСI → BaСI2 + CO2 + H2O
BaСI2 + H2SO4 → BaSO4 + 2HСI
Чистота
Бария сульфат принимают внутрь в больших дозах (до 100 г), поэтому к чистоте ЛВ предъявляются высокие требования. Особое внимание уделяют обнаружению сульфидов, солей бария, растворимых в воде (бария хлорид) или в кислотах (бария карбонат), т.к., всасываясь в организме, они вызывают тяжелые отравления.
1. Отсутствие сульфидов (S2-). К ЛВ прибавляют воду, кислоту хлороводородную и нагревают до кипения в колбе, накрытой фильтровальной бумагой, смоченной свинца ацетатом. Не должно наблюдаться потемнения бумаги.
При наличии примеси:
t o
S2- + 2HСI → СI- + H2S↑
H2S + Pb(CH3COO)2 → PbS↓ + 2CH3COOH
Бумага окрашивается в черный цвет.
2. Растворимые соли бария (BaСI2) и бария карбонат. К ЛВ прибавляют воду, ледяную уксусную кислоту и нагревают. При наличии примесей, они переходят в раствор (BaСI2 растворяется в воде, BaCO3 взаимодействует с кислотой уксусной, с образованием растворимой соли):
BaCO3 + 2CH3COOH → Ba(CH3COO)2 + CO2 + H2O
(Растворимая соль)
Бария сульфат в растворах кислот нерастворим, он остается в осадке, его отфильтровывают. В фильтрате обнаруживают растворимые соли бария по реакции с кислотой серной разведенной. Раствор должен оставаться прозрачным в течение часа.
При наличии примесей:
BaСI2 + H2SO4 → BaSO4↓ + 2HСI
Ba(CH3COO)2 + H2SO4 → BaSO4↓ + 2CH3COOH
Наблюдается помутнение раствора.
3. Отсутствие фосфатов (проводят реакцию с аммония молибдатом; не должен образовываться желтый осадок).
4. Отсутствие сульфитов и других восстанавливающих веществ (не должно наблюдаться обесцвечивания раствора калия перманганата в сернокислой среде).
5. Предельное содержание общих примесей: хлоридов, сульфатов, железа, тяжелых металлов, мышьяка.
6. Определение степени дисперсности. Основано на проверке скорости оседания взвеси, состоящей из 5 г бария сульфата и 50 мл воды в мерном цилиндре. После отстаивания в течение 15 минут граница осадка должна быть не ниже деления 12 мм.
Дата добавления: 2016-03-20; просмотров: 3645;
