Количественное определение. Комплексонометрический метод
Комплексонометрический метод. Основан на свойстве ионов цинка образовывать с трилоном Б прочные, бесцветные, растворимые в воде комплексные соединения. Способ прямого титрования. Цинка оксид предварительно растворяют в кислоте хлороводородной.
Химизм метода см. с. 44.
Используют 2 способа индикации:
1. Титрование проводят в присутствии индикатора ксиленолового оранжевого при рН 5-6. Необходимую реакцию среды создают добавлением раствора гексаметилентетрамина.
2. Титрование проводят в среде аммиачного буфера (рН=9-10) в присутствии индикатора – кислотного хром черного специального.
fэкв (ЛВ) = 1
Хранение
В хорошо укупоренной таре. Цинка оксид поглощает из воздуха углекислый газ:
ZnO + CO2 ZnCO3
Цинка сульфат является кристаллогидратом и на воздухе теряет кристаллизационную воду (выветривается).
Применение
Цинка оксид применяют наружно в качестве вяжущего, подсушивающего и дезинфицирующего средства при кожных заболеваниях.
Цинка сульфат – в качестве вяжущего и антисептического средства в офтальмологии, оториноларингологии, урологии.
СОЕДИНЕНИЯ МЕДИ
Меди сульфат Cupri sulfas
CuSO4 5H2O
Меди (II) сульфат
Получение
1. Из металлической меди действием кислоты серной в присутствии окислителей:
2Cu + 2H2SO4 + O2 2CuSO4 + H2O
3Cu + 3H2SO4 + 2HNO3 3CuSO4 + 4H2O + 2NO
2. Растворением меди (II) оксида в кислоте серной:
CuO + H2SO4 CuSO4 + H2O
Раствор упаривают до кристаллизации CuSO4 5H2O.
Описание и растворимость
Синие кристаллы или синий кристаллический порошок без запаха. Легко растворим в воде, практически нерастворим в спирте. Водные растворы имеют слабо-кислую реакцию среды, т.к. в водных растворах меди (II) сульфат подвергается гидролизу с выделением кислоты серной:
2CuSO4 + 2H2O Cu2(OH)2SO4 + H2SO4
Подлинность
1. Реакция восстановления меди (II) до металлической меди:
CuSO4 + Fe Cu + FeSO4
Железная пластинка покрывается красным налетом металлической меди.
2. Реакция осаждения раствором аммиака:
2CuSO4 + 2NH4OH Cu2(OH)2SO4 + (NH4)2SO4
Эквив. Голубой осадок
Осадок основной соли меди растворяется в избытке раствора аммиака с образованием комплексного соединения синего цвета:
Cu2(OH)2SO4 + 6NH4OH + (NH4)2SO4 2[Cu(NH3)4]SO4 + 8H2O
Избыток Синий раствор
3. Реакция осаждения раствором натрия гидроксида:
СuSO4 + 2NaOH Сu(OH)2 + Na2SO4
Эквив. Синий осадок
Образуется синий осадок, растворимый в избытке реактива (при рН 15) и в минеральных кислотах [меди (II) гидроксид проявляет слабые амфотерные свойства]:
Сu(OH)2 + 2NaOH Na2[Cu(OH)4]
Избыток Синий раствор
Сu(OH)2 + 2HCl СuCl2 + 2H2O
4. Реакция осаждения натрия сульфидом:
СuSO4 + Na2S СuS + Na2SO4
Черный осадок
Осадок меди (II) сульфида нерастворим в кислоте хлороводородной разведенной.
5. Реакция осаждения калия гексацианоферратом (II):
2СuSO4 + K4[Fe(CN)6] Сu2[Fe(CN)6] + 2K2SO4
Красно-коричневый осадок
Осадок меди (II) гексацианоферрат (II) нерастворим в разведенных кислотах, растворим в растворе аммиака.
6. Реакция комплексообразования с глицерином. Протекает в щелочной среде:
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
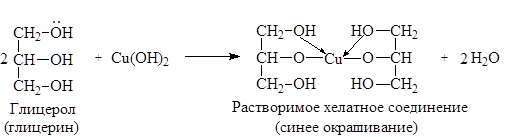
7. Реакция на сульфат-ион см. с. 44.
Чистота
1. Прозрачность раствора.
2. Содержание общих примесей: хлоридов, железа и др.
Дата добавления: 2016-03-20; просмотров: 5568;
