Основные методы, используемые в конфокальной лазерной сканирующей микроскопии
1. Иммуноцитохимия;
2. Трассирование;
3. Формирование изображения (Imaging).
4. «Живые краски» (флуоресцентные белки);
5. Передача энергии посредством флуоресцентного резонанса (FRET);
6. Восстановление флуоресценции после фотовыжигания (FRAP);
7. Визуализация времени жизни во флуоресцирующем состоянии (FLIM);
8. Флуоресцентная корреляционная спектроскопия (FCS);
9. Флуоресцентная in situ гибридизации (FISH).
Иммуноцитохимия– выявление расположения определенного антигена клетки путем получения комплексов между антителами, конъюгированными с красителями, и анализируемыми антигенами. Антитела – защитные белки, вырабатываемые плазмоцитами в ответ на действие чужеродных веществ (антигенов). Антитела имеют высокую специфичность в отношении антигенов, в связи с этим их можно использовать для выявления белков клетки. Для выявления локализации белков антитела окрашивают флюоресцирующими красителями (Например: Alexa Fluor 488, DAPI, TRITC). Главными положительными моментами этого метода является использование неограниченного числа антител на одном препарате.
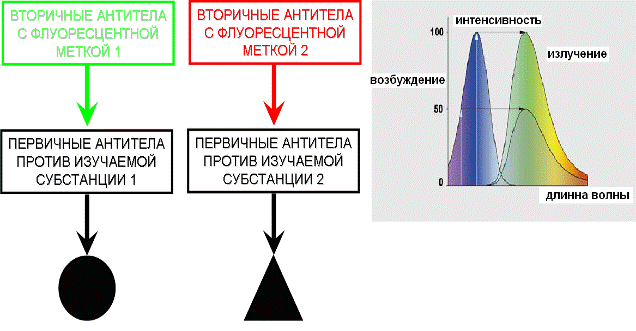
Рис.16. Спектр возбуждения и излучения вторичных антител.
Трассирование– введение в тело клетки веществ-трассеров проникающих во все структуры клетки. После конъюгации с флуоресцентным красителем позволяет выявлять структуры и компоненты клеток.
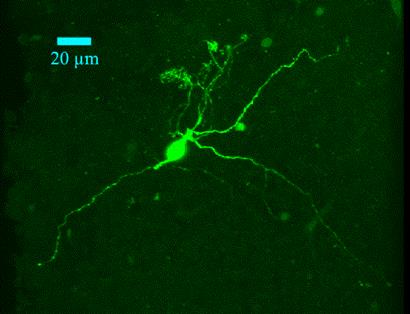
Рис. 17. Митральная клетка обонятельной луковицы (трассер – biocytin, флюорофор - avidin-Alexa 488).
Изображение ионов (Imaging ion). Этот метод позволяет изучать распределение и поступление ионов в клетку, таких как кальций, магний, натрий, цинк, калий, хлор. В клетку вводят вещество – индикатор, являющееся буфером для определяемого иона, под воздействием луча лазера КЛСМ происходит возбуждение и флюоресценция индикатора, главным образом изменяется интенсивность излучения. Названия некоторых индикаторов использующихся для выявления ионов в клетке:
· кальций – Bapta, Quin-2, Fura-2, Indo-1, Fluo-3, Fluo-4, Rhod-2;
· цинк – TSQ9, TFLZn;
· калий – PBFI;
· натрий – SBFI;
· магний – Furaptra, Indo-Mag;
· хлор – SPQ, MQAE.
В качестве примера рассмотрим применение индикаторов Fura 2 и Fluo 3 для визуализации кальция в нейроне. Индикатор Fura 2 –флуюоресцирует красным светом и чем больше концентрация кальция, тем слабее флюоресценция, а Fluo 3 – флюоресцирует зеленым и чем больше кальция, тем сильнее флюоресцирует. В результате, чем ярче флюоресценция зеленым светом, тем больше кальция входит в клетку происходит деполяризация и возбуждение, при этом сила возбуждения зависит от природы воздействующего фактора.

Рис. 18. Участок нейрона (часть клетки и дендрит в белом прямоугольнике) куда микропипеткой вводятся индикаторы (слева), каналы индикаторов (справа).
Под воздействием раздражающего фактора наблюдаем изменение соотношения кальция в клетке и динамику поступления его из окружающей среды.
Зеленые флуоресцентные белки - GFP – (Green Fluorescent Protein).Эти белки распространены у организмов, обитающих в морях и океанах, таких как медузы (Aequorea Victoria), рачки (Pontella meadi ) и т.д.
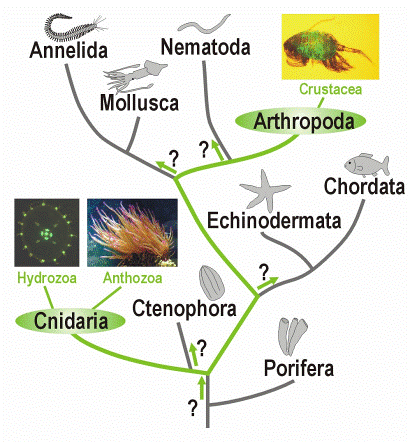
Рис. 19. Эволюционная систематика организмов имеющих GFP - подобные белки.
GFP – белок поглощает синий свет и испускает зеленый свет. В норме GFP находится в комплексе с экворином – белком, который испускает синий свет при связывании с кальцием. GFP является универсальным инструментом для прижизненного мечения клеток и клеточных структур. Введение гена GFP в клетки большинства организмов от бактерий до высших млекопитающих и растений приводило к тому, что клетки начинали светиться зеленым светом при облучении ультрафиолетом.
Молекула GFP укладывается в структуру «бочку» с одиннадцатью так называемыми бета-складками, завернутыми винтом вертикальными прутьями. «Дно» и «крышку» образуют альфа-спиральные участки того же самого белка. А внутри этой конструкции спрятана флуорофорная часть (хромофор). Хромофор формируется самой полипептидной цепью в ходе автокаталитических реакций дегидрогенизации (отнятие двух атомов водорода) и окисления молекулярным кислородом остатка аминокислоты тирозина. Окисленный тирозин реагирует с другой аминокислотой в той же цепи — глицином. В результате возникает система так называемых сопряженных связей, способная к флуоресценции. Она поглощает «ультрафиолетовые» или «синие» фотоны и испускает в ответ фотоны с меньшей энергией, соответствующие сине-зеленому свету.
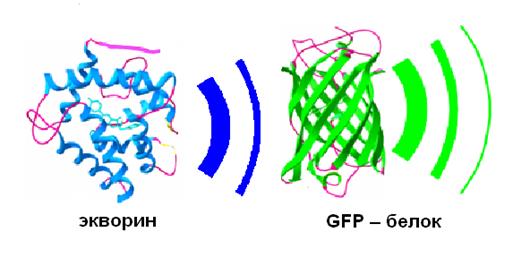
Рис. 20. Комплекс двух белков - хромофоров.
Применение GFP - белков:
1. Визуализация экспрессии гена;
2. Для белков: маркирование, отслеживание передвижения, изучение взаимодействия, измерение активности, оценивание обновления;
3. Для органелл: маркирование, изучение слияния и деления, датирование;
4. Изучение генетически закодированных рецепторов (рН, Са2+, активаторов киназ, регистрация потенциала).
Передача энергии посредством флуоресцентного резонанса - Fluorescence Resonance Energy Transfer (FRET). FRET применяется для определения расстояния между молекулами разных типов, их окружения и взаимодействия. Молекулы метятся двумя флуорохромами со спектром испускания донора перекрывающимся со спектром поглощения акцептора. Энергия от донора к акцептору передается на малых расстояниях (несколько нм) в результате резонанса между энергетическими уровнями, а вероятность возникновения резонанса зависит от расстояния между молекулами. Затем акцептор излучает энергию в видимой области спектра, которая регистрируется КЛСМ.
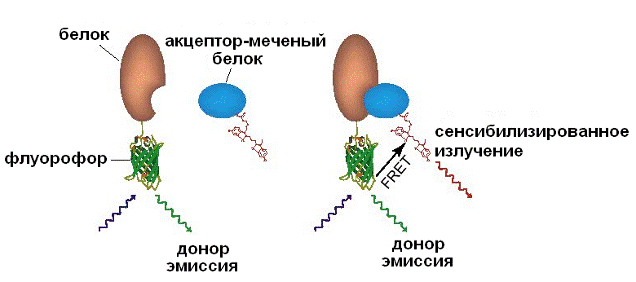
Рис. 21. Флуоресцентно-резонансный перенос энергии.
Восстановление флуоресценции после фотовыжигания - Fluorescence Recovery After Photobleaching (FRAP). FRAP применяется для исследования подвижности биоорганических молекул посредством инициации фотохимического разложения флуорохрома в зоне облучения и последующего его рассоединения с молекулами. После выжигания молекулы с флуорохромом из необлученной зоны движутся вследствие диффузии в облученную зону образца. По времени нарастания в ней флуоресценции можно судить о подвижности молекул.

Рис. 22. FRAP. После обесцвечивания участка происходит втекание определенного количества помеченного белка в обесцвеченную область.
Визуализация времени жизни во флуоресцирующем состоянии - Fluorescence Lifetime Imaging Microscopy (FLIM). Метод FLIM позволяет изучать параметры клетки и ее окружения (рН, концентрацию ионов, кислорода и т.д.), а так же разделение флуорофоров (люминофоров), которые имеют перекрывающиеся спектры испускания, но разное время жизни.
Применение FLIM для:
1. выделения красителя;
2. измерения расстояния перенос энергии;
3. измерение концентрации ионов, pH, мелких лигандов, кислорода и т.д.;
4. исследование окружающей среды (показатель преломления, мембранный потенциал);
5. изучения белка;
6. изучения внутриклеточного переноса сигнала.
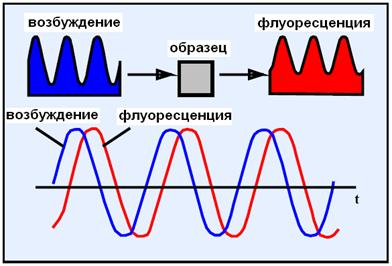
Рис. 23. FLIM. Любой перенос энергии от возбужденной молекулы к окружающим вызывает предсказуемое изменение времени жизни флуоресценции.
Флуоресцентная корреляционная спектроскопия - Fluorescence Correlation Spectroscopy (FCS). Метод FCS позволяет анализировать движение отдельных молекул внутрь и наружу маленького объема (фокус конфокального микроскопа – около 0,15 фентолитра).
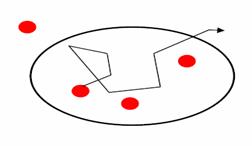
Рис. 24. FCS Движения молекул вызывают изменения флуоресценции, которые анализируются статистическими методами.
Особенности метода:
1. высокая чувствительность на уровне отдельных молекул;
2. работает на живых объектах;
3. не травмирует объект исследования;
4. даёт количественную оценку результатов;
5. имеет высокое пространственное и временное разрешение.
Метод флуоресцентной in situ гибридизации – Fluorescence in situ Hybridization (FISH). FISH – реакция гибридизации между созданным по специальным технологиям ДНК-зондом, представляющим собой нуклеотидную последовательность ограниченного размера с комплементарным ему участком ядерной ДНК исследуемого цитогенетического препарата. ДНК-зонд несет "метку", т.е. содержит нуклеотиды, напрямую связанные с флуорохромом или с гаптеном для дальнейшей визуализации антителами, несущими флуорохром. Несвязанная меченая ДНК отмывается, а затем проводится детекция гибридизованного ДНК-зонда с использованием флуоресцентного микроскопа. Совершенствование методов мечения ДНК-зондов, проведения гибридизации и детекции меченой ДНК на цитологических препаратах позволило перейти от анализа распределения в хромосомах кластерированных повторов к локализации уникальных последовательностей. В настоящее время можно выделить несколько основных подходов, широко используемых современной молекулярной цитогенетикой:
1. Идентификация материала протяженных хромосомных районов и целых хромосом;
2. Детекция в интересующем районе конкретной последовательности ДНК;
3. Анализ нарушения баланса отдельных хромосомных районов.
Для идентификации материала протяженных хромосомных районов и целых хромосом широко используются хромосом-специфичные и район-специфичные ДНК-зонды (“painting probes”), "окрашивающие" при использовании методики FISH целые хромосомы или хромосомные районы.
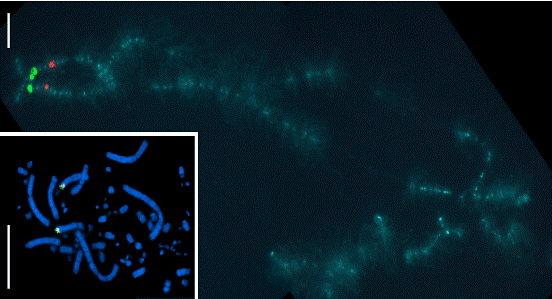
Рис. 25. Картирование длинных клонированных фрагментов геномной ДНК (BAC-клонов) на метафазных хромосомах и хромосомах в фазе ламповых щеток.
Рассмотрим некоторые варианты метода флуоресцентной in situ гибридизации.
Метод многоцветного бэндинга хромосом(MultiColor Banding - МСВ). предназначен для проведения детального анализа отдельной хромосомы. Район-специфичные ДНК-пробы метят различными флуорохромами или комбинациями флуорохромов так, что уровень сигнала каждого из ДНК-зондов варьирует по интенсивности, достигая максимума в центре и постепенно падая практически до нуля на его границах. Перекрывание профилей интенсивности сигналов ДНК-проб обеспечивает вариации соотношений интенсивностей флуоресценций различных флуорохромов вдоль хромосомы. Отношения интенсивностей могут быть переведены в псевдоцвета, и, таким образом, каждой точке изображения, а, следовательно, каждому из хромосомных районов, будет соответствовать свой псевдоцвет. Данный вариант многоцветной FISH оказался высокоэффективным при анализе не только межхромосомных, но и внутрихромосомных перестроек при онкологических заболеваниях. МСВ метод молекулярной цитогенетики подходит для анализа нарушений кариотипа, ассоциированных с определенными хромосомами и позволяет проводить анализ реорганизации хромосом как в интерфазных ядрах, так и в метафазных.

Рис. 26. Многоцветный бэндинг хромосомы 5 человека (in situ гибридизация район-специфичных ДНК-библиотек на хромосому 5). 1 - профили сигналов район-специфичных ДНК-библиотек на хромосоме 5; 2 - многоцветный бэндинг хромосомы 5; 3 - идиограмма хромосомы; 4 - флуорохромы.
Метод сравнительной геномной гибридизации (Comparative Genome Hybridization - CGH) был создан для выявления количественных нарушений в геноме. Он основан на проведении реакции гибридизации in situ с использованием в качестве ДНК-зонда всего генома. Выделенную и нормальную донорскую ДНК метят флуорохромами разного цвета, превращая их таким образом в ДНК-зонды. Эквивалентные количества этих зондов смешивают и используют при гибридизации с контрольным цитогенетическим препаратом. После проведения FISH метафазы анализируют на флуоресцентном микроскопе, определяя с помощью специализированной программы компьютерного анализа изображения интенсивность флуоресценции двух флуорохромов по всей длине каждой хромосомы. При отсутствии количественных изменений в кариотипе исследуемого образца будет наблюдаться определенное соотношение интенсивности свечения двух флуорохромов. В случае амплификации генов интенсивность сигнала соответствующего флуорохрома будет усиливаться, а в случае потери части генетического материала, наоборот, - ослабевать. Таким образом, CGH позволяет выявить геномный дисбаланс, но этот метод нельзя использовать для обнаружения сбалансированных транслокаций и инверсий, а трисомии и делеции можно определить только в том случае, если размер несбалансированного участка составляет не менее 10 млн. пар нуклеотидов.
Многоцветное кариотипирование нашло широкое применение для определения происхождения различных маркерных хромосом, которые часто наблюдаются при онкогематологических заболеваниях. Такой анализ осуществляется при использовании ДНК - зондов сплошного окрашивания к плечам или целым хромосомам (зонды WCP - whole chromosome paint). Такие зонды гибридизуются с многочисленными короткими последовательностями ДНК, расположенными по всей длине хромосомы. Таким образом, при изучении под флуоресцентным микроскопом хромосома выглядит равномерно окрашенной в определенный цвет. Техника сплошного окрашивания хромосом стала предпосылкой для нового способа исследования кариотипа - многоцветного кариотипирования (M-FISH). ДНК - зонды, используемые для такого анализа, состоят из смеси зондов сплошного окрашивания для полного набора хромосом человека, помеченных с помощью комбинации из нескольких флуорохромов, соотношение которых подобрано индивидуально для каждой пары хромосом. Использование соответствующих методов регистрации и компьютерных программ анализа изображения, оценивающих интенсивность свечения всех флуорохромов для каждой точки изображения, позволяет провести кариотипирование, при котором каждая пара хромосом имеет свой уникальный "псевдоцвет". Наиболее полный анализ кариотипа (определение нарушений набора хромосом, диагностика транслокаций, делеций, дупликаций, инверсий и инсерций) можно провести, используя различные методы дифференциального окрашиванияна основе FISH методики.
Дата добавления: 2016-02-10; просмотров: 2951;
