ГЛИКОЛИ И ИХ ПРОСТЫЕ ЭФИРЫ
Наибольшее количество a-оксидов расходуется на получение гликолей и их простых эфиров.
Этиленгликоль НОСН2-СН2ОН в больших количествах расходуется в производстве антифризов - смесей с водой, не замерзающих при низких температурах и используемых для охлаждения двигателей в зимних условиях. Этиленгликоль применяется также в синтезе полимерных материалов - полиэтилентерефталата (лавсан), ненасыщенных полиэфиров, полиуретанов, алкидных полимеров и т.д. Из него получают этиленгликольдинитрат (для производства взрывчатых веществ и порохов), а также моно- и диацетаты этиленгликоля, являющиеся хорошими растворителями.
Практически наиболее важный метод промышленного синтеза этиленгликоля состоит в гидратации оксида этилена, обычно проводимой без катализаторов при 170-200 °С и 15-кратном избытке воды. Имеются данные об осуществлении этого синтеза в более мягких условиях при катализе фосфорной кислотой.
Диэтиленгликоль НОСН2СН2ОСН2СН20Н применяют для синтеза полиэфиров. Сложные эфиры диэтиленгликоля с монокарбоновыми кислотами С7-10 служат пластификаторами и смазочными маслами. Значительные количества диэтиленгликоля расходуются на производство взрывчатого вещества - диэтиленгликольдинитрата. Диэтиленгликоль широко применяется в нефтеперерабатывающей промышленности для осушки газов и экстракции ароматических углеводородов.
Диэтиленгликоль является вторым продуктом оксиэтилирования воды, и его получают при меньшем мольном избытке воды (от 4:1 до 5:1), возвращая промежуточный этиленгликоль на реакцию.
Побочными продуктами в производстве этилен- и диэтиленгликоля являются триэтиленгликоль и полигликоли. Триэтиленгликоль применяется для синтеза полиэфиров. Три- и полигликоли в виде сложных эфиров с карбоновыми кислотами C6-10 используются как пластификаторы и смазочные масла. Их получают оксиэтилированием ЭГ в присутствии щелочи при 100-130 °С
Полигликоли, имеющие молекулярную массу менее 600, являются вязкими жидкостями, а более высокомолекулярные соединения (с молекулярной массой 4000-6000) - твердыми воскоподобными веществами («карбовакс») с низкой температурой размягчения (40-60 °С). Полигликоли имеют значение в качестве смазок, высокотемпературных теплоносителей, пеногасителей, мягчителей.
Пропиленгликоль СН3-СН(ОН)-СН2ОН может во многих областях заменять этиленгликоль. Его получают гидратацией оксида пропилена аналогично гидратации оксида этилена:
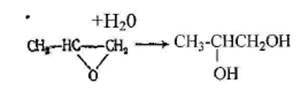
Образующиеся побочно ди- и полипропиленгликоли используют для приготовления полиэфиров, пластификаторов и смазочных масел.
Целлозольвы являются простыми моноэфирами этиленгликоля общей формулы ROCH2-СН2ОН. Они получили свое название благодаря хорошим растворяющим свойствам по отношению к эфирам целлюлозы. В качестве растворителей чаще всего используют этилцеллозольв, реже - метилцеллозольв и бутилцеллозольв:
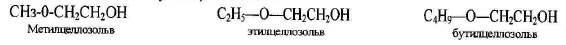
Бутилцеллозолъв и высшие целлозольвы в виде их сложных эфиров с дикарбоновыми кислотами применяются в качестве пластификаторов. Все целлозольвы получают взаимодействием оксида этилена с соответствующими спиртами при 200 °С и мольном отношении спирта к a-оксиду от 7 :1 до 8 :1.
Побочными продуктами являются карбитолы - простые моноэфиры диэтиленгликоля. Их применяют как растворители, а также для синтеза пластификаторов.
Тиогликоли образуются взаимодействием оксида этилена с сероводородом и меркаптанами при повышенной температуре; реакция протекает даже в отсутствие катализатора. При стехиометрических соотношениях сероводород дает тиодигликоль S(CH2CH2OH)2, а меркаптаны - тиоэфиры, например, β-гидроксидиэтилсульфид CH3CH2SCH2CH2OH, который служит промежуточным продуктом в производстве пестицида меркаптофоса.
Синтез тиогликолей часто осуществляют в среде продуктов реакции, барботируя через них оксид этилена и сероводород или меркаптан. Для интенсификации процесса добавляют щелочь в качестве катализатора, необходим избыток сернистого соединения.
ЭТАНОЛАМИНЫ
Монотаноламин H2NCH2CH2OH (т.кип. 172,2 °С), диэтаноламин HN(CH2CH2OH)2 (т.кип. 268 °С) и триэтаноламин N(CH2CH2OH)3 (т.кип. 360 °С) являются вязкими жидкостями, смешивающимися с водой и обладающими сильными основными свойствами. Главное их применение - очистка газов от кислотных примесей (H2S, CО2). Для этой цели используют смеси этаноламинов с добавкой воды, снижающей их вязкость. При низкой температуре они образуют с кислотными примесями соли, которые при нагревании разлагаются с регенерацией этаноламинов:

Соли этаноламинов RCOO-N+Н(СН2-СН2ОH)3 и этаноламиды высших карбоновых кислот RCONH-СН2СН2ОН обладают поверхностно-активными и пенообразующими свойствами и могут использоваться как компоненты моющих и смачивающих средств. Из этаноламинов синтезируют также морфолин, этиленимин и некоторые взрывчатые вещества.
Получают этаноламины реакцией оксида этилена с аммиаком. Процесс проводят с водным раствором NH3 при 40-60 °С, что связано с необходимостью отгонки больших количеств воды при выделении этаноламинов. Ввиду основных свойств аммиака и этаноламинов, а также из-за побочного образования гидроксида четырехзамещенного аммония, катализирующих гидратацию a-оксида, побочно образуется этиленгликоль. Для увеличения селективности в реакционную смесь добавляли СО2, нейтрализующий гидроксильные ионы.
По более новой технологии этаноламины получают из аммиака и оксида этилена только с небольшой добавкой воды, катализирующей начальную стадию реакции и снимающей индукционный период. При 100-130 °С требуется давление 7-10 МПа, чтобы сохранить реакционную смесь в жидком состоянии. При мольном отношении аммиака к оксиду, равном 15:1, получается смесь из 80 % моно-, 16 % ди- и 4 % триэтаноламина, причем побочного образования гликоля не наблюдается. Способ отличается высокой эффективностью и заметным снижением затрат на отгонку и рециркуляцию воды.
Значительный практический интерес представляют также алкил- и арилэтаноламины, получаемые реакцией оксида этилена с аминами, например с метиламином, диметиламином, диэтиламином, анилином:
Образующиеся алкил- и арилэтаноламины являются промежуточными продуктами в синтезе некоторых инсектицидов, эмульгаторов, лекарственных препаратов, вспомогательных веществ для текстильной промышленности.
Дата добавления: 2016-03-10; просмотров: 2804;
