Химия и теоретические основы синтезов из a-оксидов
Важнейшая группа реакций a-оксидов заключается в присоединении веществ, имеющих достаточно подвижные атомы водорода (Н2O, ROH, АгОН, H2S, HCN, RCOOH). Эти реакции могут протекать без катализаторов, при кислотном и основном (нуклеофильном) катализе. В последнем случае катализатором является основание, сопряженное кислоте - реагенту (т.е. НО-, RO-, АгО-, HS-, CN-, RCOO-).
Механизм реакции включает предварительное активирование a-оксида по его кислородному атому, что облегчает последующую атаку атома углерода нуклеофилом, идущую с раскрытием цикла:
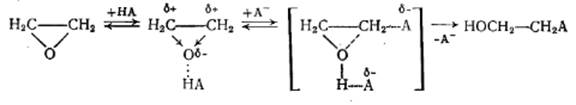
По такому же механизму протекает и некаталитическая реакция, с тем отличием, что нуклеофилом является сама молекула реагента. Так как она имеет меньшую активность, чем соответствующее сопряженное основание, некаталитическая реакция протекает значительно медленнее (достаточная ее скорость достигается при 150-200 °С, в отличие от 80-120°С при нуклеофильном катализе).
Кислотный катализ тех же реакций протонными кислотами эффективен только в сильно полярных средах (вода, низшие спирты) и имеет такой механизм:
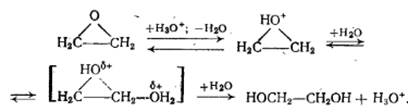
В малополярной среде протонные кислоты быстро присоединяются к a-оксидам и становятся неактивными. В этих условиях очень эффективен катализ апротонными кислотами (BF3, SnCl4), а иногда гетерогенными контактами кислотного типа (оксид алюминия, обработанный HF, и др.).
При взаимодействии с веществами, которые сами являются достаточно сильными нуклеофилами (NH3 и амины), раскрытие цикла может происходить и без помощи электрофила:
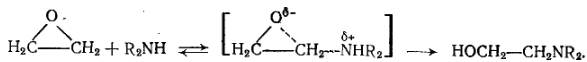
В соответствии с изложенным, скорость большинства реакций a-оксидов пропорциональна концентрациям a-оксида, протонодонорного агента (Н3O+, НА и др.) и нуклеофила (А-, НА, R2NH и др.). Однако в активировании цикла принимает участие и образующийся продукт, также обладающий кислотными свойствами.
Дата добавления: 2016-03-10; просмотров: 1238;
