Гормональная терапия
Андрогены
Фармакологические препараты. Андрогенная терапия не может быть эффективной без применения химически модифицированных аналогов тестостерона. При пероральном приеме тестостерона он всасывается в кровь воротной вены и быстро разрушается печенью, так что в системную циркуляцию поступают лишь незначительные его количества. При парентеральном введении тестостерон быстро всасывается из места инъекции и поддерживать нужную его концентрацию в плазме на постоянном уровне очень трудно. Поэтому молекулу гормона необходимо модифицировать так, чтобы скорость ее всасывания и метаболизма позволяла поддерживать эффективный уровень гормона в крови, или увеличить андрогенную активность каждой молекулы, чтобы полный андрогенный эффект достигался бы при меньшем содержании вещества в крови. Широкое клиническое применение нашли модифицрованные молекулы трех типов (рис. 330-7), полученные вследствие эстерификации 17b-гидроксильной группы, алкилирования в 17a-положении и изменения структуры колец, в частности замещений во 2-м, 9-м и 11-м положениях. Эстерификация уменьшает полярность молекулы, и поэтому стероид лучше растворяется в жировом наполнителе, применяемом для инъекций, и его поступление в кровь замедляется. Эфиры нельзя принимать через рот, поэтому их нужно вводить парентерально. Чем больше атомов углерода в присоединяемой кислоте, тем длительнее действует вещество. Имеющиеся в настоящее время эфиры, такие как тестостерона ципионат и тестостерона энантат, можно вводить 1 раз в 1—3 нед. Поскольку для проявления гормонального действия эфиры должны предварительно гидролизироваться, за эффективностью терапии можно следить, определяя содержание тестостерона в плазме в разные сроки после введения.
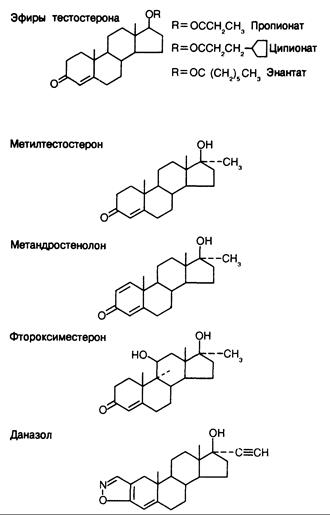
Рис. 330-7. Некоторые андрогенные препараты, доступные для фармакологического применения.
Эффективность 17a-алкилированных андрогенов (таких как метилтестостерон и метандростенолон) при приеме через рот обусловлена более медленным их катаболизмом в печени по сравнению с тестостероном. Поэтому алкилированные производные не подвергаются деградации в печени и поступают в системный кровоток. Таким образом, замещение в 17a-положении на метиловую или этиловую группы является общим признаком большинства андрогенов, сохраняющих активность при пероральном приеме. К сожалению, все 17a-алкилированные стероиды могут нарушать функцию печени, и поэтому их применение в медицине ограничено.
Другие изменения кольцевой структуры молекулы андрогенов найдены эмпирически; в одних случаях изменение замедляет инактивацию, в других увеличивает активность данной молекулы, а в-третьих влияет па превращение в другие активные метаболиты. Например, активность фтороксиместерона (Fluoxymesterone) может быть обусловлена тем, что в отличие от большинства андрогенов он почти не превращается в эстрогены в периферических тканях.
Побочные эффекты андрогенов. У женщин применение любых андрогенов сопряжено с риском вирилизации. К ранним ее проявлениям относятся угри, огрубление голоса и гирсутизм. Часто возникают нарушения менструального цикла. Отмена лечения при появлении этих признаков может способствовать их постепенному исчезновению. При длительном лечении происходит облысение по мужскому типу, возрастает степень гирсутизма и изменений голоса, гипертрофируется клитор, причем эти сдвиги во многом необратимы. Частота и выраженность этих признаков существенно варьируют. По всей вероятности, различия в реакции можно объяснить многими факторами, включая индивидуальную чувствительность, вариабельность постоянного уровня вещества в крови у разных лиц и продолжительность терапии. Чем моложе больная, тем более отчетливы признаки вирилизации. Однако явную вирилизацию можно наблюдать и у взрослых женщин.
Неизбежным следствием андрогенной терапии является задержка некоторого количества натрия в организме, и при наличии сердечных заболеваний или почечной недостаточности, а также при введении очень больших доз андрогенов (как в случае рака молочной железы) задержка натрия может достигать степени, достаточной для появления отеков. Хотя андрогены не вызывают злокачественного перерождения тканей, но они могут способствовать появлению рака предстательной железы и усиливать боли в случае этой опухоли или рака грудных желез у мужчин.
Феминизирующие побочные эффекты андрогенной терапии у мужчин изучены недостаточно. Сам тестостерон в периферических тканях может превращаться (ароматизироваться) в эстрадиол. Самым частым проявлением феминизации является гинекомастия. Увеличение грудных желез наблюдают у детей, получающих андрогены. Оно коррелирует с повышением эстрогенов в моче, что связано, по-видимому, с большей способностью детского организма превращать андрогены в эстрогены. Введение мужчинам эфиров тестостерона приводит к повышению уровня эстрогенов в плазме. У мужчин с нормальной функцией печени гинекомастия возникает обычно лишь при введении высоких доз андрогенов.
Все 17a-алкилированные андрогены вызывают задержку сульфобромфталеина натрия и часто приводят к повышению уровня щелочной фосфатазы и конъюгированного билирубина в плазме. Частота клинически явных поражений печени зависит, вероятно, от исходного состояния этого органа, но даже в отсутствие предсуществующих заболеваний печени может появляться желтуха. Под воздействием 17а-алкилированных средств повышается содержание в плазме различных белков, синтезируемых в печени. Наиболее серьезным осложнением пероральной андрогенной терапии является развитие печеночного пелиоза (заполненные кровью кисты в печени) и гепатомы. Эти формы патологии вначале были описаны у больных с апластической анемией, у многих из которых диагностировали анемию Фанкони, являющуюся фактором, предрасполагающим к злокачественным заболеваниям. Однако и пелиоз, и гепатому наблюдали у больных, получающих перорально андрогены по поводу других состояний, включая даже использование таких препаратов спортсменами. Аналогичное увеличение частоты гепатоклеточных новообразований возможно и у женщин, принимающих пероральные контрацептивы. Хотя у одних лиц после отмены препаратов эти опухоли регрессируют и приобретают доброкачественное течение, у других они быстро приводят к смерти.
Показанием к применению 17a-алкилированных андрогенов является наследственный ангионевротический отек. При этомчаболевании желательный терапевтический эффект (повышение уровня ингибитора первого компонента системы комплемента) на самом деле может отражать побочное действие самого 17сх-алкилированного стероида, а не влияние исходного андрогена. Поэтому в данном случае и эффективны такие слабые андрогены, как даназол (см. рис. 330-7). Другим показанием к применению даназола является эндометриоз (см. гл. 43).
Заместительная терапия. Цель андрогенного лечения у больных с гипогонадизмом заключается в полном или хотя бы частичном восстановлении вторичных мужских половых признаков (бороды, оволосения тела, наружных гениталий) и свойственного мужчинам полового поведения, а также воспроизведении гормональных эффектов на соматическое развитие (гемоглобин, мышечная масса, баланс азота и закрытие эпифизарных щелей). Поскольку терапию можно корригировать с учетом результатов определений содержания тестостерона в плазме, лечение андрогенной недостаточности почти всегда успешное. Парентеральное введение длительно действующих эфиров тестостерона, например 100—200 мг тестостерона энантата с интервалом в I—3 нед, обеспечивает стабильное повышение уровня тестостерона в плазме до нормы. Эффект такого лечения эфирами обусловлен высвобождением в кровь тестостерона. При первичном и длительно существующем гипогонадизме (как при синдроме Клайнфелтера) адекватная заместительная терапия обычно восстанавливает нормальную половую активность. При гипогонадальных состояниях андрогены не восстанавливают сперматогенез, но объем эякулята (образуемого в основном предстательной железой и семенными пузырьками) и вторичные мужские половые признаки достигают нормы. Воспроизводится также влияние эндогенных андрогенов на гемоглобин, задержку азота и развитие скелета.
У больных любого возраста, у которых гипогонадизм развился до ожидаемого срока полового созревания (как, например, при гипогонадотропном гипогонадизме), содержание тестостерона в плазме целесообразно медленно повышать до «взрослого» уровня. Если лечение таких больных начинают в сроки ожидаемого пубертата, то нормальные процессы мужского полового созревания протекают как обычно. Если же лечение начинают спустя долгое время после пубертатного возраста, то степень восстановления нормальной вирилизации варьирует, но у многих больных происходит относительно полное анатомическое и функциональное созревание. Мальчикам в препубертатном возрасте с гипогонадизмом и микрофаллосом для достижения наружными гениталиями нормального состояния показаны андрогены в небольших дозах с интервалами. Кратковременное лечение андрогенами (при условии тщательного наблюдения за больным) обычно не оказывает отрицательного влияния на соматический рост.
У мальчиков пубертатного возраста с изолированным гипогонадотропным гипогонадизмом или первичной тестикулярной недостаточностью андрогенную терапию начинают, как правило, между 12 и 14 годами. При небольших начальных дозах эфиров тестостерона с последующим увеличением их до 100—150 мг/м2 площади поверхности тела каждые 1—3 нед можно рассчитывать на увеличение роста в соответствии со сроком полового созревания. Время от начала лечения до появления вторичных половых признаков различно у разных больных. Увеличение размеров полового члена, снижение тембра голоса и появление других вторичных половых признаков отмечают обычно в течение первого года лечения. У здоровых мальчиков половое созревание продолжается в течение нескольких лет, и ускорение этого процесса с помощью какого-либо вмешательства нецелесообразно.
Тестостерон полностью проявляет свое действие лишь в сбалансированной гормональной среде и, в частности, в присутствии достаточного количества гормона роста. Поэтому больные препубертатного возраста с сопутствующим дефицитом гормона роста слабее реагируют на андрогены ускорением роста и появлением вторичных половых признаков, если одновременно не вводить адекватные дозы гормона роста.
Фармакологическое применение андрогенов. В расчете на то, что потенциальное положительное невирилизирующее влияние андрогенов (например, повышение задержки азота и массы мышц, увеличение уровня гемоглобина и т. д.) может перевесить любое отрицательное их действие, эти соединения применяли при различных состояниях и помимо гипогонадизма. Чаще андрогены пытались использовать для улучшения азотистого баланса при катаболических состояниях, для увеличения массы мышц и/или выносливости спортсменов, для улучшения эритропоэза при рефрактерных анемиях, включая анемию при почечной недостаточности, в качестве дополнительного средства при лечении рака молочной железы, в терапии наследственных ангионевротических отеков и эндометриоза и для лечения больных с задержкой роста различной этиологии. Большинство надежд на положительное действие андрогенов в перечисленных ситуациях оказалось иллюзорным по двум причинам. Во-первых, в фармакологических дозах андрогены у мужчин мало что добавляют к действию нормальных количеств тестикулярного гормона, а у женщин побочные вирилизирующие эффекты любых препаратов оказываются поистине страшными. Во-вторых, нет ни одного андрогенного препарата, который был бы полностью лишен вирилизирующей гормональной активности. Это и неудивительно, если учесть, что все известные эффекты андрогенов опосредуются одним и тем же высокоаффинным рецепторным белком цитоплазмы (см. рис. 330-5). Чаще всего чрезмерную нагрузку андрогенами наблюдают у мужчин-спортсменов, которые надеются таким образом увеличить мышечную массу и улучшить спортивные результаты. Однако на самом деле большинство исследований показывает, что эти средства не повышают работоспособности, а в тех редких случаях, когда это происходит, такое повышение можно отнести за счет задержки натрия и увеличения объема крови, а не за счет влияния на массу или силу мышц. Иллюзорные положительные эффекты перорального приема андрогенов ни при каких обстоятельствах не оправдывают риска их применения, и никакие запреты на эту практику нельзя считать слишком строгими. Единственными установленными показаниями для андрогенной терапии в настоящее время, кроме мужского гипогонадизма, служат отдельные случаи анемии на почве костномозговой недостаточности, наследственные ангионевротические отеки и эндометриоз.
Парентеральное введение эфиров тестостерона здоровым мужчинам практически не оказывает никакого влияния, наблюдается лишь подавление секреции гонадотропинов гипоталамо-гипофизарной системой с последующим уменьшением продукции сперматозоидов. Противопоказаний к их введению мужчинам в необходимых случаях (например, при малом росте) нет, но эффективность такого применения не доказана. В то же время побочные вирилизирующие эффекты обычных доз андрогенов у женщин требуют запрещения их использования в любых ситуациях, кроме жизненно необходимых. Даже при потенциально смертельных заболеваниях у женщин, таких как недостаточность костного мозга и рак молочной железы, применять андрогены нужно очень осторожно.
Гонадотропины
Гонадотропины используют с лечебной целью для индукции или восстановления фертильности у больных с гонадотропной недостаточностью любой этиологии. Имеются два гонадотропных препарата: менопаузный гонадотропин человека (МГЧ), выделяемый из мочи женщин в постклимактерическом периоде, и хорионический гонадотропин человека (ХГЧ), выделяемый из мочи беременных женщин. МГЧ содержит 75 ME ФСГ и 75 ME ЛГ во флаконе. ХГЧ обладает меньшей ФСГ-активностью и по своей способности стимулировать продукцию тестостерона клетками Лейдига аналогичен ЛГ. Из-за высокой стоимости МГЧ лечение обычно начинают одним ХГЧ, а МГЧ добавляют позднее для стимуляции ФСГ-зависимых стадий развития сперматид. Для того чтобы созревание яичек завершилось, необходимо высокое отношение активностей ЛГ/ФСГ и длительное лечение (3—6 мес). После того как под влиянием комбинированной терапии сперматогенез восстановился у гипофизэктомированных больных или начался у мужчин с гипогонадотропным гипогонадизмом, лечение можно продолжать одним ХГЧ.
Мужчин с олигоспермией неизвестной этиологии также лечили гонадотропинами человека. Однако показатель фертильности у них, по всей вероятности, не выше, чем в аналогичной группе нелеченых (контрольных) больных.
Дозы ХГЧ, необходимые для поддержания нормального уровня тестостерона, колеблются от 1000 до 5000 ME в неделю. Для индукции сперматогенеза применяли различные терапевтические схемы. Большинство врачей начинают с 2000 ME ХГЧ 3 раза или более в неделю, пока основные клинические параметры, в том числе и уровень тестостерона в плазме, не придут в соответствие с нормой для взрослых мужчин. Затем присоединяют МГЧ (обычно одну ампулу) 3 раза в неделю для завершения развития сперматогенеза. Продолжительность лечения, требующегося для восстановления сперматогенеза после его регрессии, различна и может достигать 12 мес.
Рилизинг-гормон лютеинизирующего гормона
В настоящее время ЛГРГ (гонадорелин) используют для проверки состояния эндокринной системы. Некоторые врачи применяют ЛГРГ и для длительного лечения бесплодия при гипогонадотропном гипогонадизме. Вводить ЛГРГ необходимо часто (25—200 нг/кг массы тела каждые 2 ч), для чего требуются портативные инфузионные насосы или периодические носовые аппликации. Эффективность лечения ЛГРГ по сравнению с гонадотропной терапией пока не установлена.
Дата добавления: 2016-03-05; просмотров: 979;
