Нарушения функции яичников
Препубертатный возраст
Половое созревание называют преждевременным, если грудные железы у девочек начинают развиваться в возрасте моложе 8 лет или если менархе наступает раньше, чем в 9-летнем возрасте. Те нарушения, при которых рано развивающиеся половые признаки соответствуют генетическому и гонадному полу, т. е. феминизацию у девочек или вирилизацию у мальчиков, называют изосексуальным преждевремениым половым созреванием, а те, при которых половые признаки не соответствуют генетическому полу, а именно вирилизацию у девочек или феминизацию у мальчиков, — гетеросексуальным преждевременным половым созреванием. Нарушения полового созревания у мальчиков описаны в гл. 330.
Изосексуальное преждевременное половое созревание. Изосексуальное преждевременное половое созревание у девочек можно разделить на три большие группы (табл. 331 -2).
Истинное преждевременное половое созревание. Истинное преждевременное половое созревание характеризуется ранним половым развитием, но протекающим в нормальной последовательности, включая повышение секреции гонадотропинов и появление овуляторных менструальных циклов. В 90% случаев речь идет о конституциональном, или идиопатическом, преждевременном пубертате. У таких пациентов не удается обнаружить причину преждевременного созревания центральной нервной системы — гипоталамо-гипофизарной оси, и диагноз приходится устанавливать методом исключения. Почти у 50% соответствующих больных обнаруживают изменения электроэнцефалограммы. Преждевременное появление вторичных половых признаков и овуляторных циклов с сопутствующим риском беременности может обусловливать значительные эмоциональные нарушения. Поэтому необходимо быстро начать лечение, которое предусматривает внутримышечное введение каждые 2—4 нед медроксипрогестерона ацетата в дозах 100—200 мг, чтобы подавить секрецию гонадотропинов. Такое лечение, как правило, угнетает синтез эстрогенов и процесс овуляции, но иногда ведет к нарушению регуляции роста и преждевременному закрытию эпифизарных щелей и вследствие этого — к низкорослости. Для угнетения синтеза эстрогенов и подавления тем самым преждевременного полового созревания применяли аналоги ЛГРГ, причем первые результаты свидетельствуют, что они предупреждают также преждевременное заращение эпифизарных щелей.
Таблица 331-2. Дифференциальная диагностика преждевременного полового созревания
I. Изосексуальное преждевременное половое созревание А. Истинное преждевременное половое созревание
1. Конституциональное
2. Органическое поражение головного мозга
3. Врожденная гиперплазия надпочечников Б. Преждевременный псевдопубертат
1. Опухоли яичников
2. Опухоли надпочечников
3. Синдром Олбрайта—Мак-Кьюна
4. Гипотиреоз
5. Синдром Сильвера
6. Эстрогенсодержащие медикаментозные средства В. Неполное преждевременное половое созревание
1. Преждевременное телархе
2. Преждевременное адренархе
3. Преждевременное пубархе II. Гетеросексуальное преждевременное половое созревание А. Опухоли яичников Б. Опухоли надпочечников В. Врожденная гиперплазия надпочечников
В 10% случаев к преждевременному половому созреванию приводят органические заболевания головного мозга, включая опухоли (гипоталамические глиомы, астроцитомы, эпендимомы, герминомы и гамартомы), энцефалит, менингит, гидроцефалию, травмы головы, склероз серого бугра и нейрофиброматоз. Больных с такими нарушениями важно отличать от лиц с идиопатическим преждевременным половым созреванием, причем у больных, считавшихся «идиопатическими», иногда находят перечисленные опухоли. Правда, у большинства больных с достаточно тяжелыми органическими повреждениями, чтобы вызвать преждевременное половое созревание, имеются явные неврологические снмптомы. Поэтому в обследование всех больных с преждевременным пубертатом необходимо включать рентгенографию черепа и компьютерную томографию мозга. Успех лечения зависит от характера процесса, но хирургическая операция и облучение иногда помогают даже при опухолях, если их удается своевременно и правильно локализовать.
Редко причиной изосексуального преждевременного полового развития является вирилизирующая врожденная гиперплазия надпочечников вследствие дефицита 21-гидроксилазы у девочек, лечить которых начали позже 4—8-летнего возраста. После начала заместительной терапии глюкокортикоидами у таких больных может проявляться истинное изосексуальное преждевременное половое созревание (см. гл. 325).
Преждевременный псевдопубертат. Преждевременным псевдопубертатом называют состояние, при котором у девочек вследствие повышенного образования эстрогенов происходит феминизация, но овуляции и циклических менструаций не возникает. Наиболее часто причиной преждевременного псевдопубертата служат кисты или опухоли яичников, секретирующие эстрогены (гранулезотекаклеточные опухоли). Гранулезотекаклеточные опухоли в сочетании с полипозом кишечника и пигментацией слизистых оболочек встречаются при синдроме Пейтца—Егерса. К другим опухолям яичников, которые секретируют эстрогены (или андрогены, превращающиеся в эстрогены вне яичников), относятся дисгерминомы, тератомы, цистаденомы и карциномы (см. также гл. 296). Опухоли яичников можно обнаружить при ректоабдоминальном исследовании. Эффективны также ультразвуковое исследование, компьютерная томография и/или лапароскопия. Тератомы и хориокарциномы яичников, а также другие карциномы, секретирующие ХГЧ, не вызывают преждевременного полового созревания у девочек, если только опухоль не секретирует одновременно эстрогены (ХГЧ или ЛГ в отсутствие ФСГ не стимулируют продукцию эстрогенов яичниками). Редко причиной изосексуального преждевременного полового созревания бывают также феминизирующие опухоли надпочечников, которые либо непосредственно вырабатывают эстрогены, либо секретируют слабые андрогены, выступающие в роли предшественников эстрогенов во внежелезистых тканях.
Кроме того. причинами преждевременного псевдопубертата могут быть следующие:
1) синдром Олбрайта—Мак-Кьюна (множественная фиброзная остеодисплазия), характеризующийся гиперпигментацией кожных покровов (пятна цвета кофе с молоком), кистозно-фиброзной дисплазией костей и преждевременным половым развитием. У некоторых из этих больных секреция гонадотропинов повышена, но у большинства отмечают низкие уровни этих гормонов и независимое от них преждевременное половое развитие. Иногда при этом синдроме наблюдается истинное преждевременное половое созревание (см. гл. 334); 2) первичный гипотиреоз, при котором возрастает секреция не только тиреотропин-рилизинг-гормона (ТРГ), но и других гипоталамических гормонов, что ведет к повышению уровня ФСГ и секреции эстрогенов яичников, часто на фоне галактореи; 3) синдром Сильвера, или врожденная асимметрия, сопровождающаяся низкорослостью и преждевременной феминизацией; 4) лечение средствами, содержащими эстрогены, включая применение эстрогенсодержащих кремов по поводу сыпи или прием каких-либо эстрогенов внутрь.
Неполное изосексуальное преждевременное половое созревание. Это такое состояние, когда преждевременно появляется какой-либо один признак полового созревания, причем эти признаки могут быть разными. Увеличение грудных желез у девочек, не достигших возраста 4 лет (преждевременное телархе), без других проявлений секреции эстрогенов и без преждевременного созревания скелета относят за счет временного повышения чувствительности к тем небольшим количествам эстрогенов, которые присутствуют в крови до полового созревания. Это состояние обычно не прогрессирует и исчезает спонтанно. Иногда раньше обычного начинается рост волос в подмышечных впадинах и/или на лобке (так называемые преждевременные адренархе и пубархе) без появления других вторичных половых признаков. Это обусловлено секрецией андрогенов надпочечниками и представляет собой вариант нормального полового созревания. От синдромов вирилизации он отличается отсутствием клиторомегалии. В таких случаях лечения не требуется и половое созревание укладывается в средние сроки.
Гетеросексуальное преждревременное половое созревание. Вирилизация у девочек препубертатного возраста обусловливается обычно врожденной гиперплазией надпочечников или секрецией андрогенов опухолями яичников или надпочечников. Проявления вирилизации описаны в гл. 46. У девочек с врожденной гиперплазией надпочечников вирилизация служит обычно главной причиной сомнений в половой принадлежности (см. гл. 333).
Обследование больных с преждевременным половым созреванием. Обследование по поводу преждевременного полового развития включает тщательный сбор анамнеза и медицинское освидетельствование с применением ректоабдоминального исследования, ультразвукового исследования области живота, оценки костного возраста и определения уровня гонадотропинов (а также андрогенов или эстрогенов по показаниям). При подозрении на неврологические нарушения, если нет признаков опухоли яичников или надпочечников, показаны рентгенография черепа и дальнейшие диагностические исследования.
Репродуктивный возраст
Нарушения менструального цикла. Патологические маточные кровотечения. В период между менархе и менопаузой почти у каждой женщины происходит одно или несколько патологических маточных кровотечений. Это любые кровотечения, различающиеся по периодичности, длительности или объему от таковых при нормальном менструальном цикле. Для описания характера таких нарушений использовали различные термины — «меноррагия» (гиперменорея), «метроррагия» и «менометроррагия»). Логичнее, однако, разделять патологические маточные кровотечения на связанные с овуляторными или ановуляторными циклами.
Овуляторные циклы. В норме менструальные кровотечения при овуляторных циклах спонтанны, регулярны, цикличны, предвидимы и зачастую сопровождаются ощущением дискомфорта (дисменорея). Отклонения от этого при сохранении регулярности и предсказуемости циклов чаще всего обусловливаются органическими заболеваниями путей оттока. Например, регулярные, но удлиненные и обильные кровотечения в отсутствие общих заболеваний (гиперменорея) могут быть следствием патологии матки, в частности подслизистых лейкомиом, аденомиоза или полипоза эндометрия. Регулярные, циклические, предвидимые менструации, характеризующиеся мажущимися или прозрачными выделениями, называются гипоменореей. Они обусловлены обструкцией путей оттока, как это наблюдается при внутриматочных спайках или рубцевании шейки матки. Кровотечения, наблюдающиеся между регулярными овуляторными менструациями, нередко также обусловлены повреждениями шейки матки и эндометрия. Исключением из патологических маточных кровотечений, зависящих от органических заболеваний матки, являются случаи регулярных кровотечений с частотой, превышающей один раз через каждый 21 день (полименорея). Такие циклы могут представлять собой вариант нормы.
Ановуляторные циклы. Маточные кровотечения, непредсказуемые по объему, срокам начала и продолжительности, обычно безболезненные, называют дисфункциональными маточными кровотечениями. Это нарушение связано не с патологией матки, а с хронической ановуляцией и возникает при прерывании нормальной прогрессирующей последовательности фолликулярной и лютеиновой фаз, определяемой доминантным фолликулом и образующимся из него желтым телом. Как отмечалось выше, нормальное маточное кровотечение при овуляторных циклах обусловливается прекращением влияния прогестерона; для его начала требуется предварительная подготовка эндометрия эстрогенами (при проведении пробы с отменой прогестерона у кастрированных женщин или женщин в постклимактерическом периоде кровотечения, как правило, не возникает).
Дисфункциональные маточные кровотечения наблюдаются у женщин, у которых нарушена синхронность активности отдельных звеньев гипоталамо-гипофизарно-яичниковой системы, необходимой для регулярных овуляторных циклов. Это чаще всего бывает в начале и конце репродуктивного периода, но иногда и как следствие временных стрессов, вызванных интеркуррентными заболеваниями.
С другой стороны, в основе первичных дисфункциональных маточных кровотечений могут лежать по крайней мере три патофизиологических механизма.
1.Кровотечение, связанное с отменной эстрогенов, возникает при отмене ранее назначенных эстрогенов кастрированным женщинам или женщинам в постклимактерическом периоде. Как и при других дисфункциональных маточных кровотечениях, это менструальное кровотечение обычно безболезненно.
2. Кровотечение прорыва, вызванное эстрогенами, возникает при длительной постоянной стимуляции эндометрия эстрогенами, которая не прерывается циклами повышения и угасания секреции прогестерона. Это наиболее часто встречающееся дисфункциональное маточное кровотечение, оно обусловлено ановуляцией, сопровождающейся хронической ациклической продукцией эстрогенов, как это наблюдается у женщин с болезнью поликистозных яичников. В анамнезе у таких женщин можно найти упоминание о нерегулярных, непредсказуемых менструациях, олигоменорее или аменорее (см. ниже). Кроме того, кровотечение эстрогенного прорыва может возникать у женщин с гипогонадизмом, хронически (без перерыва) получающих эстрогены, или у женщин с эстрогенсекретирующими опухолями яичника. Кровотечение эстрогенного прорыва может быть очень сильным и непредсказуемым по продолжительности, объему и времени возникновения. Характерно истончение эндометрия, поскольку в интервале между кровотечениями он не успевает восстановиться полностью.
3. Кровотечение прорыва, вызванное прогестероном, возникает при чрезмерно высоком отношении уровней прогестерона и эстрогенов, например, у женщин, длительно пользующихся низкодозовыми пероральными контрацептивами.
Обследование больных с дисфункциональными маточными кровотечениями в репродуктивном периоде начинают с тщательного опроса о характере предшествующих менструаций и возможной гормональной терапии в прошлом. Причем необходимо исключить кровотечения из прямой кишки, мочевого пузыря, влагалища или шейки матки. В случае маточного кровотечения следует исключить также возможность нарушений, связанных с беременностью, такие как аборт или эктопическую беременность. Если дисфункциональное маточное кровотечение установлено, рациональный подход к лечению заключается в следующем. При первом появлении дисфункционального кровотечения, если оно не слишком обильно и не сопровождается дискразией, больную можно оставить под наблюдением. Умеренно тяжелое кровотечение можно купировать относительно высокими дозами эстрогенных пероральных контрацептивов, назначаемых в течение 3 нед. Эффективен также прием 3—4 пилюль низкодозовых пероральных контрацептивов в день в течение 1 нед с последующим уменьшением количества пилюль до обычной дозы на протяжении 3 нед. При более тяжелом маточном кровотечении необходимы госпитализация, постельный режим и внутримышечные инъекции эстрадиола валерата (10 мг) и 17a-гидроксипрогестерона капроата (500 мг), а также внутривенные или внутримышечные введения конъюгированных эстрогенов (25 мг). После первых неотложных мер следует назначить препараты железа, а рецидив кровотечения предотвратить приемом пероральных контрацептивов в течение 2—3 мес (или более, если нежелательна беременность). В других случаях каждые 2—3 мес можно индуцировать менструации пероральным приемом 10 мг медроксипрогестерона ацетата 1 или 2 раза в день в течение 5 дней. Если гормональная терапия не купирует маточное кровотечение, необходимо провести биопсию эндометрия или расширение шейки с выскабливанием. Вообще у женщин с риском рака эндометрия (т. е. приближающихся к возрасту менопаузы или с массивным ожирением) показано взятие проб маточной ткани еще до назначения гормональной терапии. У овулирующих женщин репродуктивного возраста рак эндометрия возникает редко.
Аменорея. Аменореия —это отсутствие менархе у девочек, достигших 16-летнего возраста, независимо от выраженности вторичных половых признаков, или отсутствие менструаций на протяжении 6 мес у женщин с ранее периодическими менструациями. Однако необходимо обследовать и женщин, не удовлетворяющих этим критериям, если: 1) больная и/или члены ее семьи обеспокоены таким состоянием; 2) у 14-летней девочки не развиты грудные железы или 3) отмечается неопределенность половой принадлежности или вирилизация (см. гл. 333). Различают аменорею первичную (у женщин, никогда не менструировавших) и вторичную (у женщин, у которых какое-то время менструации были, а затем прекратились). Как первичную, так и вторичную аменорею могут вызвать некоторые заболевания. Например, у большинства женщин с дисгенезией гонад диагностируют первичную аменорею, но иногда у них сохраняется несколько фолликулов и какое-то время происходит овуляция, так что иногда возможна беременность. Для больных с хронической ановуляцией (болезнь поликистозных яичников) чаще характерна вторичная аменорея, но иногда наблюдается и первичная. Поэтому деление аменореи на первичную и вторичную помогает дифференциальной диагностике меньше, чем классификация, основанная на исходных физиологических причинах: 1) анатомических дефектах; 2) недостаточности яичников и 3) хронической ановуляции с наличием или отсутствием эстрогенов.
Анатомические дефекты. Препятствовать менструальным кровотечениям могут различные анатомические или структурные дефекты женских половых путей. Эти дефекты могут заключаться в слипании или сращении половых губ, что часто связано с нарушениями полового развития, в частности с женским псевдогермафродитизмом (врожденная гиперплазия надпочечников или действие материнских андрогенов in utero) (см. гл. 333). Причиной аменореи могут быть также врожденные дефекты влагалища, неперфорированная девственная плева и поперечные влагалищные перегородки. У таких женщин менструальная кровь скапливается за барьером и могут возникать циклические боли в животе.
Наблюдают также агенезию мюллеровых структур (синдром Майера—Рокитанского—Кюстера—Хаузера) (см. гл. 333), уступающую по частоте в качестве причины первичной аменореи только дисгенезии гонад. Женщины с этим синдромом обладают кариотипом 46, XX, у них хорошо развиты вторичные половые признаки и нормально функционируют яичники, но влагалища у них нет либо оно резко гипоплазировано. Матка представлена лишь рудиментарными тяжами рогов с обеих сторон, но если в них есть эндометрий, то, как и при других формах обструкции путей оттока, могут возникать циклические боли в животе и скопление крови. У 30% больных имеются анатомические нарушения мочеполовых путей и у 10% аномалии скелета, главным образом позвоночника. При постановке диагноза важно отличить больных с агенезией мюллеровых структур от таковых с полной тестикулярной феминизацией, при которой генетические мужчины (46,XY) стести-кулами дифференцируются у лиц с женским фенотипом, имеющих слепо заканчивающееся влагалище и не имеющих матки. У лиц с тестикулярной феминизацией грудные железы развиты по женскому типу, но плохо растут волосы под мышками и на лобке. Это заболевание обусловлено дефектом внутриклеточного цитоплазматического белка-рецептора андрогенов, что приводит к выраженной резистентности к действию тестостерона (см. гл. 333). Тестикулярную феминизацию можно диагностировать., если в сыворотке будет обнаружен уровень тестостерона, характерный для мужчин, или кариотип 46,XY, тогда как диагноз агенезии мюллеровых структур ставят по кариотипу 46,ХХ, двухфазной базальной температуре тела, характерной для овулирующих женщин, и повышенному уровню прогестерона во время лютеиновой фазы.
Редко причиной отсутствия матки у фенотипических женщин с кариотипом 46,XY и отсутствием полового созревания служит так называемый синдром тестикулярной регрессии или тестикулярной агенезии (см. гл. 333).
К другим видам патологии матки, которые вызывают аменорею, относится обструкция шейки матки вследствие рубцевания или стеноза, часто возникающая в результате хирургической операции, электрокоагуляции или криотерапии. После выскабливания (обычно по поводу послеродового кровотечения или с целью терапевтического аборта), осложненного инфекцией, может возникнуть деструкция эндометрия (синдром Ашермана). Этот диагноз подтверждают гистеросальпингографией или обнаружением при гистероскопии рубцевания или спаек эндометрия.
При нарушении путей оттока показано хирургическое вмешательство. Восстановительная операция при агенезии влагалища приводит к появлению нормальных менструаций и возможности забеременеть только при наличии интактной матки.
Недостаточность яичников. Первичная недостаточность яичников сопровождается повышением содержания гонадотропинов в плазме и может быть вызвана рядом причин. Наиболее частая причина — дисгенезия гонад, при которой отсутствуют зародышевые клетки и яичники замещены фиброзными тяжами (см. также гл. 60 и 333). Женщин с дисгенезией гонад можно разделить на две группы по кариотипу. Чаще данная патология обусловлена делецией генетического материала в Х-хромосомах (примерно 60% случаев дисгенезии гонад). Кариотип 45,Х находят почти у 50% больных, причем у большинства из них имеются соматические дефекты, включая низкорослость, шейные складки, куриную грудь и сердечно-сосудистые нарушения, в совокупности называемые фенотипом Тернера. У остальных больных с измененными Х-хромосомами находят хромосомный мозаицизм со структурными нарушениями Х-хромосомы или без таковых. Наиболее частая форма мозаицизма — это 45,Х/46,ХХ. У больных с кариотипом 45,Х опухоли половых желез возникают редко, но у жещин с хромосомным мозаицизмом с участием Y-хромосомы встречаются злокачественные опухоли гонад. Поэтому во всех случаях аменореи, обусловленной недостаточностью яичников, следует проводить хромосомный анализ и при наличии Y-хромосомы гонадныетяжи необходимо удалять. Примерно у 90% лиц с дисгенезией гонад вследствие делеции генетического материала в Х-хромосоме никогда не бывает менструальных кровотечений, а у остальных 10% сохраняется достаточное число фолликулов, чтобы возникали менструации, а в редких случаях — и беременность. Продолжительность менструального и репродуктивного периода у таких женщин всегда укорочена.
Около 10% женщин с двусторонними тяжами вместо гонад имеют нормальный кариотип 46,XX или 46,XY; в таких случаях говорят о чистой дисгенезии гонад. Из-за дефицита эстрогенов преждевременного заращения эпифизарных щелей у таких больных не происходит, и при наличии нормального хромосомного набора рост их либо нормален, либо выше среднего. Чистая дисгенезия гонад не является фенотипически или хромосомно гомогенным состоянием. Ряд случаев обусловлен сцепленными с Х-хромосомой или аутосомными генетическими дефектами. Другие возможные причины включат хромосомный мозаицизм, ограниченный тканью половых желез, и деструкцию зародышевой ткани in utero под действием инфекций и других факторов внешней среды. Примерно у 10% таких лиц с кариотипом 46,XY развиваются признаки вирилизации, включая клиторомегалию; частота появления опухолей в гонадных тяжах у них повышена. Поэтому при наличии Y-хромосомы, как отмечалось выше, гонадные тяжи следует профилактически удалять. Примерно у 60% женщин с кариотипом 46,XX менструаций не бывает, а у остальных они появляются один или несколько раз, и иногда эти женщины могут забеременеть.
К другим причинам недостаточности яичников и аменореи относят дефицит 17a-гидроксилазы или 17,20-десмолазы, преждевременную яичниковую недостаточность, синдром резистентности яичников, химиотерапию или лучевое лечение по поводу злокачественных новообразований. Дефицит 17 й-гидроксилазы характеризуется первичной аменореей, половым инфантилизмом и гипертензией, которая связана с повышенной продукцией дезоксикортикостерона (ДОК), тогда как у женщин с дефицитом 17,20-десмолазы первичная аменорея и половой инфантилизм наблюдаются на 4)оне нормального артериального давления (см. гл. 325 и 333). Преждевременную яичниковую недостаточность, или преждевременную менопаузу, диагностируют у тех женщин, у которых менструации прекратились в возрасте до 40 лет. В этом случае яичники напоминают таковые у женщин в постклимактерический период, а именно содержат очень мало или вообще не содержат фолликулов вследствие ускоренной их атрезии. Преждевре.менная недостаточность яичников, обусловленная антителами к овариальной ткани, может быть одним из компонентов полигландулярной недостаточности, включающей еще и недостаточность надпочечников, гипотиреоз и другие аутоиммунные нарушения (см. гл. 334). Редкой формой яичниковой недостаточности является синдром резистентности яичников. В этом случае в яичниках содержится много фолликулов, но их развитие останавливается до антральной стадии, возможно, из-за резистентности первых к действию ФСГ. Чтобы отличить это состояние от 46,ХХ-варианта чистой дисгенезии гонад, при котором также не происходит полового созревания, необходимо проводить биопсию яичников. Однако с клинической точки зрения такая дифференциация бесполезна, поскольку в обоих случаях лечение по поводу бесплодия обычно неэффективно.
Хроническая ановуляция. Хроническая ановуляция служит причиной многих (80% или более) эндокринологических нарушений в гинекологии. У женщин с хронической ановуляцией не происходит спонтанной овуляции, но при адекватном лечении овуляция возможна. Яичники таких больных неспособны циклически секретировать эстрогены. Нужно отличать женщин, у которых продукция эстрогенов достаточна, чтобы после терапии прогестероном возникло кровотечение отмены, отбельных, у которых не вырабатывается такое количество эстрогенов, чтобы появилось кровотечение, связанное с отменой прогестерона, у которых часто наблюдается дисфункция гипоталамо-гипофизарной системы.
Хроническая ановуляция в присутствии эстрогенов. О женщинах с хронической ановуляцией, у которых после введения прогестерона возникает кровотечение отмены, говорят, что они находятся в состоянии «эструса», обусловленного ациклической продукцией эстрогенов (в основном эстрона) вследствие внежелезистой ароматизации присутствующего в крови андростендиона. Этот синдром называют болезнью пол и кистозных яичников (БПКЯ). Он характеризуется бесплодием, гирсутизмом, ожирением и аменореей или олигоменореей. Если у больных с БПКЯ и появляются спонтанные маточные кровотечения, нельзя предсказать их начало, продолжительность и объем. Иногда они могут быть тяжелыми. Дис4)ункциональные маточные кровотечения обусловливаются, как правило, эастрогеновым прорывом (см. выше).
Это заболевание, которое может передаваться по наследству как аутосомно-доминантный или сцепленный с Х-хромосомой признак, впервые описано Стейном и Левенталем как характеризующееся увеличенными поликистозными яичниками. Однако в настоящее время известно, что данный синдром и сопутствующие ему эндокринные нарушения обусловлены разнообразными патологоанатомическими изменениями в яичниках, причем лишь некоторые из них приводят к увеличению этих желез и ни одно не является патогномоничным. Чаще всего обнаруживают белые гладкие склеротические яичники с утолщенной капсулой, множеством кист фолликулов, находящихся на разных стадиях атрезии, гиперплазией теки и малым числом (или полным отсутствием) белых тел. В других случаях в яичниках находят гипертекоз, при котором строма гиперплазирована и может содержать перегруженные липидами лютеиновые клетки. Таким образом, БПКЯ —это клинический диагноз, базирующийся на сочетании хронической ановуляции с различной выраженностью признаков избытка андрогенов.
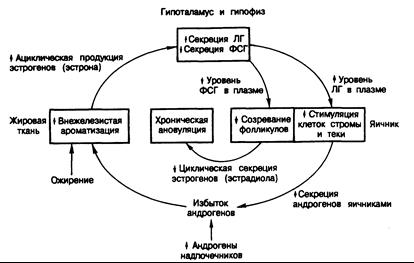
Рис. 331 -7. Предполагаемый механизм инициации и поддержания хронической ановуляции при болезни поликистозных яичников (БПКЯ).
Инициирующим моментом может служить избыток надпочечниковых андрогенов вне яичников. Лечение больных с БПКЯ предполагает размыкание этого порочного круга в различных точках. (По S.S.C. Yen a. R.B.JafTe, 1986: U. Goebelsman, in: D.R.Mishell Jr. a. V. Davajan.)
У большинства женщин с БПКЯ первая менструация появляется в ожидаемое время, но предсказать начало маточных кровотечений, их продолжительность и объем невозможно. Аменорея наступает через разное время, хотя у некоторых больных она бывает и первичной. Признаки избытка андрогенов (гирсутизм) появляются обычно ко времени менархе. Существует мнение, что это заболевание возникает как усиленное адренархе у девочек с ожирением (рис. 331-7). Сочетание повышенного уровня надпочечниковых андрогенов с ожирением должно было бы приводить к усиленному образованию эстрогенов вне яичников и создавать ациклическую цепь положительной обратной связи с секрецией ЛГ и отрицательной обратной связи с секрецией ФСГ. В результате отношение ЛГ/ФСГ в плазме должно было бы превышать 2, что характерно для данного состояния. Повышенный уровень ЛГ мог бы затем приводить к гиперплазии клеток стромы и теки в яичниках и увеличивать продукцию андрогенов, что в свою очередь обеспечивало бы приток субстратов для периферической ароматизации и поддерживало хроническую ановуляцию. В далеко зашедших случаях главным источником андрогенов служат яичники, но и надпочечники могли бы продолжать секретировать чрезмерные количества этих соединений. Чем больше выражено ожирение, тем сильнее должна была бы проявляться эта последовательность событий, поскольку клетки жировой ткани ароматизируют андрогены в эстрогены, которые в свою очередь усиливают неадекватную секрецию ЛГ за счет механизма положительной обратной связи.
Следовательно, основное нарушение при БПКЯ — это неадекватность одного из сигналов, поступающих с периферии в гипоталамо-гипофизарную систему. Действительно, последняя нормально реагирует на высокий уровень эстрогенов, а антиэстрогены, также как кломифенцитрат, могут индуцировать овуляцию. Нарушение сохраняется вследствие повышенного содержания эндорфинов и ингибина в плазме. Представление о том, что главный дефект заключается в неадекватности сигналов, подтверждается результатами исследования яичников. Яичниковые фолликулы у женщин с БПКЯ обладают низкой арома-тазной активностью, но под влиянием ФСГ ароматазная активность в них может нормализоваться. Таким образом, ановуляция обусловливается не патологией яичников, а недостаточностью ФСГ и избытком ЛГ. Между СПКЯ, или гипертекозом, папиллярно-пигментной дистрофией кожи и сахарным диабетом вследствие инсулинорезистентности существует связь. Однако механизмы этой связи остаются неясными. изменения уровня гонадотропинов повторяют таковые при нормальном половом созревании (см. рис. 331-1).
Кроме того, к возникновению гипогонадотропного гипогонадизма приводят хронические инвалидизирующие заболевания, такие как болезни почек в последней стадии, злокачественные новообразования или синдром нарушенного всасывания. Считают, что и в этих случаях принимает участие гипоталамический механизм.
Лечение при хронической ановуляции, возникающей в результате гипоталамических нарушений, заключается в преодолении стрессовой ситуации, уменьшении физической нагрузки и, если возможно, предотвращении снижения массы тела. Такие женщины, по-видимому, предрасположены к остеопорозу, и тем из них, кто не планирует беременности, показана заместительная терапия эстрогенами для индукции и сохранения нормальных вторичных половых признаков и профилактики снижения костной массы. Если же беременность желательна, показано лечение гонадотропинами или гонадорелином (см. раздел «Лечение»). По возможности лечение должно быть направлено на восстановление функции гипоталамуса.
При нарушении функции гипофиза может возникать эстрогендефицитная форма хронической ановуляции. В ее основе лежат по меньшей мере два механизма: выпадение секреции гонадотропинов при поражениях, сопровождающихся разрушением или ингибированием гонадотро4)ных клеток (хромофобные аденомы, синдром Шихена), и торможение секрекции гонадотропинов под влиянием избытка пролактина (пролактинома). На долю опухолей гипофиза приходится примерно 10% всех внутричерепных опухолей, и они могут вообще не секретировать гормоны или секретировать один или несколько гормонов (см. гл. 321). В прошлом большинство гипофизарных опухолей считали нефункционирующими хромофобными аденомами, но у 50—70% подобных больных оказался повышенным уровень пролактина. Это может определяться как опухолевой секрецией пролактина (пролактиномы), так и тем, что опухолевая масса препятствует нормальному ингибиторному влиянию гипоталамуса на секрецию пролактина.
Различают микропролактиномы (менее 10 мм в диаметре) и макропролактиномы (более 10 мм). Больные с избытком пролактина, сопровождающимся низким содержанием ЛГ и ФСГ, составляют особую подгруппу лиц с гипогонадотропным гипогонадизмом. Повышенное содержание пролактина в сыворотке отмечают у 10% или более женщин с аменореей и больше чем у 50% женщин с галактореей и аменореей. При данном заболевании аменорея чаще всего обусловлена снижением или отсутствием продукции эстрогенов, но иногда при пролактинсекретирующих опухолях сохраняются нормальные овуляторные менструации или развивается хроническая ановуляция в присутствии эстрогенов. Большинство пролактинсекретирующих аденом растет медленно, а некоторые, достигнув определенных размеров, прекращают рост. Все большее число случаев диагностирования пролактинсекретирующих аденом можно объяснить, по-видимому, повышенной настороженностью врача, более совершенными методами лучевой диагностики и появлением радиоиммунологических методов определения пролактина. Однако, поскольку, по данным старых аутопсийных материалов, 9—23% гипофизарных аденом обнаруживали у женщин, не предъявлявших никаких жалоб, клиническое и прогностическое значение небольших микроаденом остается неясным. Тем не менее, когда при опухолях любого размера у женщин появляются симптомы аменореи или галактореи, следует подумать о лечении, а когда имеются нарушения полей зрения или тяжелые головные боли, необходимо начать терапию бромокриптином или прибегнуть к нейрохирургическому вмешательству. Вопросы обследования, дифференциальной диагностики и лечения больных с гиперпролактинемией рассматривались в гл. 321. Во второй половине беременности пролактинсекретирующие опухоли гипофиза могут увеличиваться в размерах и приводить к головным болям, сдавлению перекреста зрительных нервов и слепоте. Поэтому при желании беременности до индукции овуляции необходимо исключить гипофизарные опухоли.
Крупные опухоли гипофиза, такие как хромофобные аденомы, независимо от наличия гиперпролактинемии, сопровождаются недостаточностью не только гонадотропинов, но и других гормонов (см. гл. 321).
Надолго краниофарингиом, которые, как полагают, развиваются из остатков кармана Ратке, приходится 3% внутричерепных новообразований. Чаще они появляются на втором десятилетии жизни и могут прорастать в супраселлярную область. В большом проценте случаев эти опухоли кальцифицируются и их можно обнаружить при обычной рентгенографии черепа. У больных часто отмечают половой инфантилизм, задержку полового созревания и аменорею в результате гонадотропной недостаточности. Краниофарингиома может вызывать также нарушение секреции ТТГ, АКТГ, гормона роста и вазопрессина.
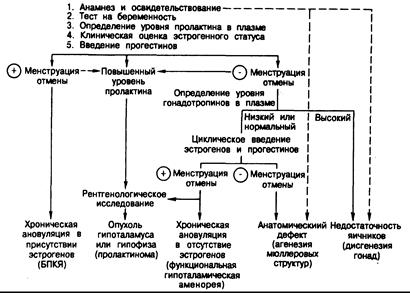
Рис. 331 -8. Схема обследования женщин с аменореей.
Наиболее часто встречающиеся диагнозы для каждой категории указаны в скобках. Пунктирные линии означают, что в некоторых случаях правильный диагноз может быть установлен только на основании данных анамнеза и освидетельствования.
Пангипопитуитаризм может возникать спонтанно, быть следствием хирургического или лучевого лечения по поводу гипофизарных аденом или развиваться в результате послеродового кровотечения (синдром Шихена). В последнем случае у больных имеются характерные клинические проявления — отсутствие лактации или овуляции, потеря лобкового и подмышечного оволосения, гипотиреоз и надпочечниковая недостаточность (см. гл.321).
Обследование больных с аменореей. Общая схема обследования женщин с аменореей приведена на рис. 331-8. При первом врачебном осмотре следует уделять особое внимание трем показателям: 1) степени развития грудных желез, наружных гениталий, лобкового и подмышечного оволосения; 2) эстрогенному статусу в настоящее время и 3) наличию или отсутствию матки. Пока не будет доказано обратное, у всех женщин с аменореей следует подозревать беременность. Даже если анамнез и освидетельствование не подтверждают этих подозрений, целесообразно исключить беременность с помощью соответствующего проверочного теста. После того, как это сделано, причину аменореи часто удается выяснить по данным анамнеза и обследования. Например, если у ранее менструировавших женщин в анамнезе есть указания о ранее проводившемся выскабливании, это позволяет предположить синдром Ашермана; у женщин с первичной аменореей и половым инфантилизмом следует проводить дифференциальную диагностику между дисгенезией гонад и гипопитуитаризмом, и, кроме того, уже при простом освидетельствовании нередко можно предположительно диагностировать дисгенезию гонад (синдром Тернера) или анатомические дефекты в путях оттока (агенезии мюллеровых структур, тестикулярная феминизация или стеноз шейки матки). После установления предполагаемой конкретной причины необходимо подтвердить диагноз (например, исследовать хромосомный кариотип или определить содержание гонадотропинов в плазме). Уже при первом обследовании полезно также определить содержание пролактина в сыворотке.
Эстрогенный статус оценивают по влажности и складчатости слизистой оболочки влагалища, а также по способности шеечной слизи растягиваться и при высыхании образовывать картину папоротника. При неопределенности получаемых результатов показано введение прогестинов; чаще всего назначают медроксипрогестерона ацетат в дозе 10 мг внутрь
1 или 2 раза в течение 5 дней или внутримышечно вводят прогестерон в масле в дозе 100 мг (следует подчеркнуть, что прогестерон ни в коем случае нельзя вводить, пока не будет исключена беременность). Если уровень эстрогенов достаточен (а пути оттока интактны), то в течение недели после окончания введения прогестинов возникает менструальное кровотечение. В этом случае (кровотечение отмены) диагностируют хроническую ановуляцию в присутствии эстрогенов, обычно это болезнь поликистозных яичников.
Если кровотечения отмены не возникает, последующие действия зависят от результатов ранее проведенного определения уровня пролактина. При повышенном содержании пролактина в плазме или наличии галактореи следует провести рентгенографию гипофиза. При нормальном уровне пролактина в плазме у ановуляторных женщин с отсутствием эстрогенов следует определить содержание гонадотропинов. Если оно повышено, диагностируют недостаточность яичников. Если же оно понижено или находится в пределах нормальных колебаний, диагностируют либо гипоталамо-гипофизарные нарушения, либо анатомический дефект в путях оттока. Как уже отмечалось, патологию путей оттока обычно можно заподозрить или установить, исходя из данных анамнеза и освидетельствования. Если на основании осмотра не удастся сделать определенного заключения, целесообразно провести курс эстрогенов с прогестинами (1,25 мг пероральных конъюгированных эстрогенов в день в течение 3 нед с добавлением 10 мг медроксипрогестерона ацетата в последние 5—7 дней курса эстрогенов) с проверкой через 10 дней. Если кровотечения не возникает, диагноз синдрома Ашермана или других анатомических дефектов путей оттока подтверждают с помощью гистеросальпингографии или гистероскопии. Если же после сочетанного введения эстрогенов с прогестинами кровотечение отмены возникает, то следует думать о хронической ановуляции в отсутствие эстрогенов (функциональная гипоталамическая аменорея). В таких случаях показано лучевое исследование гипоталамо-гипофизарной области независимо от уровня пролактина, поскольку существует опасность пропустить опухоль гипоталамо-гипофизарной системы и поскольку диагноз функциональной гипоталамической аменореи устанавливается методом исключения (см.гл. 321).
Бесплодие. Бесплодие, или неспособность забеременеть в течение 1 года половой жизни без предохранения, наблюдают примерно у 10—15% супружеских пар. Это одна из наиболее распространенных жалоб, по поводу которой женщины обращаются к гинекологу. В 40% случаев бесплодие семей связано с патологией мужчин (см. гл. 44 и 330). У женщин оно в 30% обусловливается отсутствием овуляции, в 50% — патологией тазовых органов, такой как заболевание маточных труб или эндометриоз, и в 10% — патологией шейки матки. У 1 0—20% бесплодных женщин причину этого состояния выяснить не удается. В таких семьях большой процент бесплодия можно объяснить иммунологическими причинами. Наконец, бесплодие у женщин может быть обусловлено дисфункцией лютеиновой фазы, когда овуляция, по-видимому, происходит, но прогестерона вырабатывается недостаточно, чтобы эндометрий мог подготовиться к имплантации оплодотворенной яйцеклетки. Это состояние относят на счет неадекватной секреции или действия ФСГ с последующим недостаточным образованием эстрогенов доминантным фолликулом во время фолликулярной фазы.
Обследование бесплодных пар начинают с выяснения виновника бесплодия — мужчины или женщины. Для этого проводят анализ семенной жидкости мужчины (см. гл. 330) и проверяют наличие овуляции у женщины. Овуляторность цикла проверяют путем ежедневного в течение месяца измерения базальной температуры тела. Иногда температурную кривую не удается точно зарегистрировать и в качестве доказательства овуляции можно использовать повышенный уровень прогестерона во время лютеиновой фазы. Для доказательства овуляции или дисфункции лютеиновой фазы целесообразно также гистологически исследовать биоптаты эндометрия.
Если бесплодие сопровождается аменореей, то дальнейшие действия соответствуют последовательности, показанной на рис. 331-8. Когда в основе бесплодия лежит ановуляция, вызванная болезнью поликистозных яичников, можно индуцировать овуляцию кломифен-цитратом, менопаузными гонадотропинами человека, гонадорелином или иногда клиновидной резекцией яичников. В случаях гиперпролактинемии для индукции овуляции применяют бромокриптин. При обнаружении пролактином необходимость соответствующего лечения перед индукцией овуляции остается спорной. Терапевтические мероприятия, рекомендуемые в таких ситуациях, включают наблюдение, повторные курсы бромокриптина, облучение или хирургическую резекцию опухоли (см. гл. 321).
Для проверки состояния маточных труб и полости матки можно проводить гистеросальпингографию. Дальнейшее обследование маточных труб и яичников предполагает диагностическую лапароскопию и выяснение окрашиваемости фимбрий после чресшеечного введения краски во время лапароскопии. Микрохирургическая коррекция поврежденных и ранее перевязанных маточных труб приводит к явному росту частоты беременностей. Другой способ лечения заключается в удалении околотрубных и фибриальных спаек с помощью лазерного пучка. Эндометриоз можно обнаружить при лапароскопии, влечение при эндометриозе, сопровождающемся бесплодием, включает хирургическую резекцию эндометриальных имплантатов или временное подавление гонадотропинов даназолом (400— 800 мг внутрь в дробных дозах в течение 4—6 мес), аналогами ЛГРГ (распыление в нос или подкожная инъекция), а также длительное назначение низкодозовых пероральных контрацептивов для стимуляции регрессии имплантатов.
Роль патологии шейки матки в генезе бесплодия оценивают, исследуя шеечную слизь в соответствующее время после совокупления. Это исследование лучше проводить перед самой овуляцией (12—13-й день), когда шеечная слизь разжижается и растягивается и по ее виду можно судить о проникновении и выживании сперматозоидов в женских половых путях. Лечение при бесплодии, обусловленном такими причинами, часто остается неэффективным.
Если все другие способы лечения безуспешны, можно попытаться осуществить оплодотворение in vitro переносом эмбриона (ОИВ-ПЭ). Показания к ОИВ-ПЭ у бесплодных пар включают непроходимость труб, патологию шейки матки, эндометриоз, олигоспермию и бесплодие, неподдающееся объяснению. Кломифенцитратом и/или МГЧ индуцируют рост множества фолликулов и получают их при лапароскопии или путем трансабдоминальной или трансвагинальной аспирации под контролем ультразвука. После оплодотворения эмбрионы переносят в полость матки. Имеются данные, что после применения ОИВ-ПЭ успех достигается почти в 30% случаев. К беременности приводило и использование модификации ОИВ-ПЭ, известной как внутрифаллопиев перенос гамет (ВФПГ), при которой смесь сперматозоидов и яйцеклеток вводят в конец маточной трубы при лапароскопии.
Медицинские аспекты беременности. Возможность беременности следует учитывать у всех женщин детородного возраста, обследуемых по поводу любого заболевания или при решении вопроса о хирургической операции. Такие воздействия, как рентгеновское облучение, назначение лекарственных и наркотических средств, могут представлять опасность для развивающегося плода. При беременности может ухудшаться течение многих заболеваний, в том числе гипертензии, болезней сердца, легких, почек и печени, а также метаболических и эндокринных нарушений. У всех женщин с нарушенными влагалищными кровотечениями или аменореей в течение детородного периода следует подозревать осложнения беременности, такие как незавершенный аборт, эктопическая беременность или патология тро4юбласта (пузырный занос или хориокарцинома). В анамнезе женщин с этими осложнениями беременности часто имеются указания на боли в животе и влагалищные кровотечения; у них могут обнаруживаться и признаки кровоизлияния в брюшную полость.
Хориокарцинома составляет особую проблему из-за нечеткости проявлений. Половина этих злокачественных новообразований обнаруживается при беременностях, осложенных пузырным заносом, а остальные выявляют после спонтанного аборта, эктопической беременности или нормальных родов. Больные могут поступать в клинику с признаками кровотечения в брюшную полость вследствие разрыва матки, печени или яичников, симптомами поражения легких (кашель, кровохарканье, плевритная боль, одышка и дыхательная недостаточность) или со стороны желудочно-кишечного тракта, обычно с признаками хронической кровопотери или меленой. Кроме того, у больных могут быть проявления метастазов в головном мозге или почках. Болезнь диагностируют по повышенному уровню b-субъединицы ХГЧ в плазме. В лечебных целях используют химиотерапевтические препараты (актиномицин D и/или метотрексат). (Проявления хориокарциномы у мужчин описаны в гл. 297.)
Опухоли яичников (гл. 296).
Лечение
Прогестины
Прогестины чаще используют в сочетании с эстрогенами для обеспечения полного созревания эндометрия, при лечении состояний гипогонадизма и в комбинированных противозачаточных пилюлях. Терапию прогестинами применяют также для индукции прогестинового эффекта на подготовленный эстрогенами эндометрий (диагностический тест при аменорее), для игибирования гонадотропинов гипофиза (преждевременное половое созревание у девочек и содержащие только прогестины противозачаточные средства), для профилактики гиперплазии при БПКЯ и в качестве паллиативного средства при раке эндометрия и грудных желез или для лечения при эндометриозе. Даже когда нужно получить прямой эффект от прогестинов, имеющиеся пероральные средства заменяют синтетические аналоги природного гормона. К пероральным прогестинам относятся медроксипрогестерона ацетат, мегестриола ацетат (Megestrol acetate), норэтистерон и норгестрел (Norgestrel). К парентеральным средствам относятся прогестерон в масле, суспензия медроксипрогестерона ацетата и 17-оксипрогестерона капронат.
Из нежелательных побочных эффектов прогестинов следует отметить кровотечение прорыва, возникающее при длительном их применении, а также тошноту, рвоту и гирсутизм. Алкилзамещенные в 17a-положении производные могут нарушать функцию печени. Прогестины противопоказаны при известной или подозреваемой беременности, так как они повышают опасность врожденных уродств.
Эстрогены
Препараты эстрогенов используют для лечения больных с недостаточностью гонад, предупреждения беременности и терапии при дисфункциональных маточных кровотечениях и раке грудных желез. (Применение эстрогенов при раке грудных желез рассматривается в гл. 295.) Однако ни один из имеющихся пероральных или парентеральных эстрогенных препаратов не воспроизводит динамики концентрации эстрадиола, характерной для пременопаузальных женщин с нормальным циклом (см. рис. 331-5). Эстрогены, которые можно назначать внутрь, — это либо нестероидные агенты (такие как диэтилстильбэстрол), имитирующие действие эстрадиола, конъюгаты эстрогенов, которые приобретают активность только после гидролиза (сульфаты эстрогенов, преимущественно эстрон-сульфат из мочи беременной кобылы) или аналоги эстрогенов, не метаболизирующие в эстрадиол (местранол, хинестрол) (рис. 331-9). При пероральном приеме даже малейших коли-
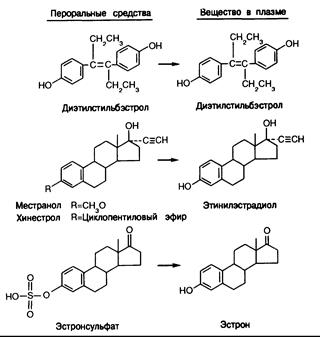
Рис. 331 -9. Циркулирующие в крови 4)ормы введенных эстрогенных препаратов.
честв эстрадиола он быстро превращается в эстрон. Поскольку пероральная терапия не воспроизводит и не имитирует суточный характер секреции отсутствующего гормона, ее можно считать лишь фармакологическим, но не физиологическим способом замещения. Подобно этому, и парентеральное введение эстрогенов редко воспроизводит физиологическую ситуацию. Препараты конъюгированных эстрогенов, назначаемые как парентерально, так и перорально, плохо превращаются в эстрадиол, а эфиры эстрадиола (эстрадиола бензоат и валерат) редко воспроизводят нормальный уровень эстрадиола в плазме. При парентеральном введении эстрогенов удается создать постоянный их уровень в крови, что находит применение в терапии при симптомах менопаузы. В различные периоды жизни заместительная терапия эстрогенами вызывает разные побочные эффекты.
Гипоэстрогенизм. У женщин со сниженной продукцией эстрогенов, будь то вследствие патологии яичников (дисгенезия гонад) или гипогонадотропного гипогонадизма, циклическое введение эстрогенов следует начинать во время ожидаемого полового созревания. чтобы обеспечить появление и сохранение вторичных половых признаков и предотвратить остеопороз. Чаще всего применяют конъюгированные эстрогены (0,625—1,25 мг в день внутрь) и этинил-эстрадиол (Ethinyl estradiol) или его предшественники (0,02—0,05 мг внутрь). Большинство врачей рекомендуют в последние несколько дней месячного курса эстрогенов добавлять медроксипрогестерона ацетат (5—10 мг в день), чтобы предотвратить гиперплазию эндометрия при длительном лечении эстрогенами. При нарушении менструальных кровотечений у женщин, получающих заместительную эстрогенную терапию, требуется гистологическое исследование эндометрия. Такую заместительную терапию или пероральные контрацептивы (см. ниже) можно применять также с целью подавления секреции гипофизарных гонадотропинов, как это делают в случае БПКЯ, где главная цель лечения заключается в подавлении продукции яичниковых андрогенов до тех пор, пока больная не захочет забеременеть.
Для нормального развития вторичных половых признаков у девочек и для ликвидации симптомов менопаузы может потребоваться временное введение больших количеств эстрогенов (вдвое превышающих обычную поддерживающую дозу у взрослых). Еще большие дозы парентеральных эстрогенов (10 мг эстрадиола валерата или 25 мг конъюгированных эстрогенов) в сочетании с прогестинами могут быть необходимы в некоторых случаях дисфункционального маточного кровотечения. Заместительная терапия эстрогенами (100 нг/кг) стимулирует рост у женщин с дисгенезией гонад, но более высокие дозы (400 нг/кг) не влияют на рост. Не говоря уже о потенциальных поздних побочных эффектах всех эстрогенов (см. ниже), эти дозы могут вызывать специфические реакции, включая тошноту, рвоту и отеки.
Контроль рождаемости. Поскольку любые методы контрацепции сопряжены с вредными побочными эффектами, все врачи должны знать показания, механизм действия и последствия применения соответствующих средств. Кроме того, беременность может осложнить течение хронических заболеваний, поэтому многим больным следовало бы рекомендовать предохранение от беременности.
Выбирать метод контроля рождаемости должны сами пациенты. К широко используемым методам относятся ритмичность половых контактов и воздержания, барьерные методы, включая применение презервативов, гелей, пенистых средств, свечей и диафрагм, внутриматочные средства (ВМС), гормональные контрацептивы, стерилизация и аборт.
Методика ритмичности контактов и воздержания и барьерные методы эффективны при правильном и постоянном их использовании, но в реальной жизни они часто неэффективны из-за неточности выполнения. Тем не менее эти методы реже других дают неблагоприятные последствия, а если они и возникают, то ограничиваются небольшими местными аллергическими реакциями. Поэтому их следует рекомендовать при наличии противопоказаний к использованию других средств.
Противозачаточные пилюли и ВМС эффективны, но вызывают серьезные побочные эффекты.
Внутриматочные средства. Большинство ВМС дает эффект в 95—98%. Они разнообразны по форме и размеру, но >- или Т-образные вызывают минимальную боль при установке и редко выпадают. Некоторые ВМС содержат медь, что увеличивает их эффективность, а другие — медленно высвобождающиеся прогестины, что требует их замены с интервалом в 1—3 года. Считается, что ВМС предотвращают беременность, вызывая хроническую воспалительную реакцию в эндометрии и тем самым создавая неблагоприятную среду для имплантации бластоцисты.
После установки ВМС необходимо периодически проверять правильность их положения. Они могут вызывать как незначительные, так и серьезные побочные эффекты. Часты-
Таблица 331-3. Состав пероральных контрацептивов
| Название | Эстроген | Доза, мкг | Прогестин | Доза, мг |
| Комбинированный тип | ||||
| Постоянный тип | ||||
| Содержание эстрогена бо | лее 50 мкг | |||
| Эновид Е (Enovid E) | Местранол | Норэтинодрел | 2,5 | |
| Эновид 5 | То же | То же | ||
| Овулен (Ovulen) | » » | Этинодио.чи дпацетат | ||
| Норинил 2 (Norinyl 2) | » » | Норэтистедрон | ||
| Норинил 1/80 | » » | То же | ||
| Орто-новум 2 (Ortho-Novum 2) | » » | » » | ||
| Орто-новум 1/80 | » » | » » | ||
| Содержание эстрогена 50 мкг | ||||
| Орто-новум 1/50 | Местранол | » » | ||
| Норинил 1/50 | Местранол | » » • | ||
| Овкон 50 (Ovcon 50) | Этинил-эстрадиол | » » | ||
| Оврал (Ovral) | То же | Норгестрел | 0,5 | |
| Демулен (Demulen) | » » | Этинодиола диацетат | ||
| Норлестрин 2,5/50 (Norlestrin) | » » | Норэтистерона ацетат | 2,5 | |
| Норлестрин 1./50 | » » | Тоже | ||
| Содержание эстрогена менее 50 кг | ||||
| Орто-новум 1/35 | Этинил-эстрадиол | Норэтистедрон | ||
| Норинил 1+35 | То же | То же | ||
| Модикон (Modicon) | » » | » » | 0,5 | |
| Бревикон (Brevicon) | » » | » » | 0.5 | |
| Овкон 35 | » » | » » | 0,4 | |
| Демулен 1/35 | » » | Этинодиола диацетат | ||
| Лоэстрин 1,5/30 (Loestrin) | » » | Норэтистерона ацетат | 1,5 | |
| Лоэстрин 1/20 | » » | То же | ||
| Нордетт (Nordette) | » » | Левоноргестрел | 0,15 | |
| Ло-оврал (Lo-Ovral) | » » | Норгестрел | 0,3 | |
| Двухфазный тип | ||||
| Орто-новум 10/11 | ||||
| Первые 10 дней | » » | Норэтистерон | 0,5 | |
| Следующие 11 дней | » » | То же |
| Название | Эстроген | Доза, мкг | Прогестин | Доза, мг |
| Трехфазный тип | ||||
| Орто-новум 7/7/7 | ||||
| Первые 7 дней | » » | » » | 0,5 | |
| Вторые 7 дней | » » | » » | 0,75 | |
| Третьи 7 дней | » » | » » | ||
| Три-норинил (Tri-Norinyl) | ||||
| Первые 7 дней | » » | » » | 0,5 | |
| Следующие 9 дней | » » | » » | ||
| Следующие 5 дней | » » | » » | 0,5 | |
| Трифазил (Triphasil) | » » | |||
| Первые 6 дней | » » | Левоноргестрел | 0,05 | |
| Следующие 5 дней | » » | То же | 0,075 | |
| Следующие 10 дней | » » | » » | 0,125 | |
| Три-левеин (Tri-Levein) | ||||
| Первые 6 дней | » » | » » | 0,05 | |
| Следующие 5 дней | » » | » » | 0,075 | |
| Следующие 10 дней | » » | » » | 0,125 | |
| Содержащие только | ||||
| прогестин | ||||
| Микронор (Micronor) | Нет | Норэтистерон | 0,35 | |
| Hop Q. D. (Nor Q. D.) | » | Норэстистерон | 0,35 | |
| Овретт | » | Норгестрел | 0,075 |
ми причинами отказа от ВМС служат межменструальные выделения и усиленные кровотечения, а также боли и спазмы во время менструаций. Кроме того, во время менструаций приспособление может выпасть, а женщина и не догадается об этом. Самым серьезным побочным эффектом является инфекция тазовых органов, приводящая иногда к развитию трубно-яичникового абсцесса с последующим бесплодием. Поэтому многие гинекологи не рекомендуют ранее нерожавшим женщинам пользоваться такими средствами. Кроме того, при использовании ВМС возрастает вероятность эктопической беременности, так как они препятствуют только внутриматочной, но не внематочной беременности. Из-за повышенной частоты спонтанных и септических абортов при пользовании ВМС в случае возникновения беременности их нужно удалять. Женщины, у которых появляются хроническое тяжелое кровотечение, боли внизу живота, повышенная температура или выделения, должны удалить ВМС.
Пероральные контрацептивы. Пероральными контрацептивами пользуются более 200 млн женщин в мире и 1 из 4 жительниц США в возрасте до 45 лет. Популярность этим средствам обеспечивают легкость приема, низкий показатель беременности (менее 1%) и относительно малая частота побочных эффектов.
Среди пероральных контрацептивных пилюль наиболее широко применяются либо комбинированные таблетки, либо те, которые нужно менять в определенные сроки (двух-или трехфазные). Перечень пероральных контрацептивов, продающихся в США, приве-
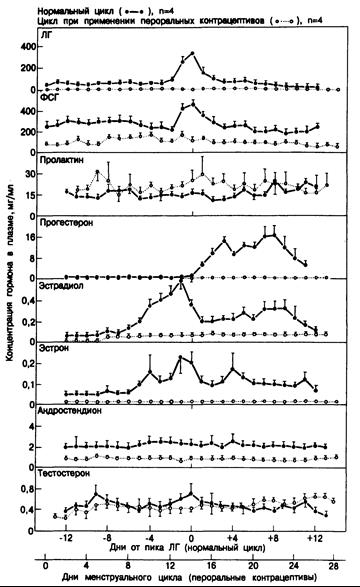
Рис. 331-10. Механизм действия противозачаточных пилюль.
Приведены среднесуточны; концентрации гормонов в плазме в течение овариального цикла у четырех овулирующих женщин и четырех женщин, пользующихся пероральными контрацептивами комбинированного типа. Данные по нормальному овариальному циклу соотнесены с днями перед пиком ЛГ и после него. Первый день цикла у женщин, пользующихся контрацептивами, соответствует первому дню маточного кровотечения. Цифры отражают среднюю ± стандартную ошибку при определениях у четырех женщин. (По В. R. Сагг et al., 1979).
Таблица 331-4. Показатели смертности за 1 год в связи с контролем рождаемости (на 100 000 женщин)
| Метод контрацепции | Возрастные группы | |||||
| 15—19 лет | 20—24 года | 25—29 лет | 30—34 года | 35—39 лет | 40—44 годя | |
| Не применяется (смертность связана средами) | 7,4 | 9,1 | 14,8 | 25,7 | 28,2 | |
| Пероральные контрацептивы: | ||||||
| курящие женщины | 2,4 | 3,6 | 6,8 | 13,7 | 51,4 | 117,6 |
| некурящие женщины | 0,5 | 0,7 | 1,1 | 2,1 | 14,1 | |
| вмс | 1,3 | 1,1 | 1,3 | 1,3 | 1,9 | 2,1 |
| Аборт | 0,5 | 1,1 | 1,3 | 1,9 | 1,8 | 1,1 |
| Барьерные методы (смертно
Дата добавления: 2016-03-05; просмотров: 1139; |
Генерация страницы за: 0.065 сек.
