8 страница
Ядов, обладающих специфическим действием на гонады (или непосредственный аппарат регуляции их функций), относительно мало. К ним относятся этиленимин, хлоропрен, марганец, винилхлорид, фенол и некоторые другие.
Клиническими проявлениями воздействия химических веществ на репродуктивную функцию женщины являются изменения менструального цикла, бесплодие, раннее наступление климакса, самопроизвольные аборты и выкидыши, осложнения беременности и родов, рождение маловесных детей, врожденные уродства и т. д.
Указанные патологии отмечаются у работниц производства синтетических каучуков, капролактама, химических волокон, стирольных и фенолформальдегидных пластических масс, резины, искусственной кожи, суперфосфатных удобрений, синтеза органических соединений (метионин, резиновые ускорители и т. д.), синтетических смол, коксохимических заводов при контакте с пестицидами, фенолом, ацетоном, бензолом, стиролом, нитрилом акриловой кислоты, ртутью, свинцом, радонистым натрием, сероуглеродом, формальдегидом и т. д.
Клиническими проявлениями изменений репродуктивной функции мужчин могут быть различные типы нарушений спермообразования: бесплодие, нарушение сексуального поведения.
Выраженную негативную роль при бесплодии играет интоксикация такими химическими веществами, как свинец, мышьяк, сероуглерод, ртуть, фосфор, этилированный бензин. Значительно чаще бесплодие встречается у мужчин, занятых в производстве эфира, синтетических масел, анилиновых красителей.
Классификация ксенобиотиков, действующих на репродуктивную систему. Единой классификации химических веществ, действующих на репродуктивную систему, не существует. В промышленной токсикологии была создана классификация потенциальной опасности влияния промышленных веществ на репродуктивную функцию в зависимости от величины зоны специфического действия яда Zsp. Чем выше зона специфического действия, тем опаснее вещество. Рекомендуемый коэффициент запаса Qs при переходе от порога хронического действия к ПДК также зависит от величины Zsp (табл. 8.4).
Таблица 8.4. Классификация потенциальной опасности влияния
промышленных веществ на репродуктивную функцию
| Класс опасности | Zsp | Qs |
| I. Чрезвычайно опасные | > 10 | > 50 |
| II. Высокоопасные | 4–10 | 10–50 |
| III. Умеренно опасные | 1–3 | до 10 |
| IV. Малоопасные | < 1 | обычный |
При обосновании коэффициента запаса для веществ, действующих на репродуктивную систему, представляется необходимым дополнительно учитывать вариабельность видовой чувствительности по показателям токсичности, поправочный коэффициент, отражающий характер выявляемых эффектов, их обратимость и значимость.
В странах Евросоюза, США, Канаде классификация химических веществ основывается на наличии или отсутствии убедительных доказательств связи химического соединения с возникновением нарушений процессов репродукции как у человека, так и других организмов. Ведущую роль при этом играет экспертная оценка, основанная на унифицированных критериях.
В России разрабатывается единая классификация репротоксикантов, однако существует настоятельная необходимость гармонизации имеющихся классификаций для создания единой международной классификации веществ, действующих на репродукцию [22].
8.5. Специфика воздействия радиоактивного излучения
В настоящее время известны следующие виды излучений радиоактивных веществ: α-лучи (поток положительно заряженных атомов гелия);
β-лучи (поток отрицательно заряженных электронов, скорость которых близка к скорости света и которые обладают большей проникающей способностью, чем α-лучи); γ-лучи (подобные рентгеновским, но обладающие еще большей проникающей способностью и представляющие собой электромагнитные волны). Наряду с этими видами различают еще нейтронное, протонное и рентгеновское излучения.
Источники радиоактивного излучения. Человек и все живые организмы на Земле подвергаются облучению от естественных и искусственных источников радиации. Совокупность потоков излучения, происходящих от естественных источников, попадает на земную поверхность из космоса и поступает от радиоактивных веществ, находящихся в земной коре. Однако дозы облучения, получаемые человеком и живыми организмами от естественных источников радиации, малы и составляют природный радиационный фон Земли, к которому организм адаптировался за время эволюции. Согласно современным представлениям, радиационный фон играет важную роль в качестве движущей силы изменчивости биологических видов, а также одного из факторов поддержания неспецифической резистентности организма.
Источниками внешнего воздействия на организм преимущественно являются радиоактивные вещества, присутствующие в земной коре. В каменных зданиях интенсивность внешнего излучения в несколько раз ниже, чем на открытой местности, что объясняется экранирующими свойствами конструкционных материалов. По мере увеличения высоты над поверхностью моря роль земных источников внешнего облучения уменьшается. При этом возрастает космическая составляющая природного радиационного фона.
К источникам искусственного излучения относятся ядерные взрывы, рентгеновские трубки, ускорители заряженных частиц, выбросы радионуклидов предприятий ядерной энергетики, а также источники ионизирующих излучений в научных исследованиях, медицине, различных отраслях промышленности и сельском хозяйстве [25].
Воздействие ионизирующего облучения на организм человека можно условно подразделить на внешнее, контактное и внутреннее, хотя в практике встречаются случаи и комплексного воздействия.
Внешним облучением называют воздействие на организм ионизирующего облучения, приходящего извне. Источниками внешнего облучения являются β-, γ-источники, нейтронные источники, рентгеновские установки, ускорители заряженных частиц, ядерные реакторы, нейтронные генераторы и др.
Контактным облучением называют такое облучение, когда источник ионизирующего излучения непосредственно соприкасается с кожным покровом организма. Это может произойти при различных авариях на производстве или при грубых нарушениях правил работы с источниками ионизирующего излучения.
Внутренним облучением называют облучение радионуклидами, проникшими в организм через органы дыхания, желудочно-кишечный тракт и кожные покровы.
Наиболее опасным является ингаляционное поступление радионуклидов. Второй по значению путь – поступление радионуклидов с пищей и водой. Наименее изучен путь поступления радиоактивных веществ через кожу, которая до недавнего времени считалась для них эффективным барьером. Однако в последующем было установлено, что радионуклиды в составе жидких и газообразных соединений проникают через кожу иногда в значительных количествах и со скоростью, сравнимой со скоростью проникновения этих веществ через дыхательные пути.
Радиоактивные вещества обладают высокой химической активностью, способны интенсивно включаться в биологический круговорот и мигрировать по биологическим цепям, одним из звеньев которых может быть человек (рис. 8.2).
Радиоактивное излучение оказывает следующее влияние на организм:
ослабляет облученный организм, замедляет рост, снижает сопротивляемость к инфекциям и т. д.;
уменьшает продолжительность жизни, сокращает показатели естественного прироста из-за временной или полной стерилизации организма;
обладает генотоксичностью;
оказывает кумулятивное действие, вызывая необратимый эффект [5].
Дозиметрические величины. Для своевременного принятия решений по защите от воздействия ионизирующих излучений необходимо иметь объективную и исчерпывающую информацию о параметрах радиационной обстановки. Для количественной оценки уровня радиационного воздействия введено понятие дозы излучения. Применяются три основных вида доз:
экспозиционная доза – мера количества ионизирующего излучения, физическим смыслом которой является суммарный заряд ионов одного знака, образующихся при облучении воздуха в его единичной массе. Единицей измерения экспозиционной дозы в системе СИ является кулон, деленный на килограмм (Кл/кг), а внесистемной единицей измерения экспозиционной дозы является рентген (Р);
поглощенная доза – мера количества ионизирующего излучения, физическим смыслом которой является количество энергии, передаваемой излучением единичной массе вещества. В системе СИ поглощенную дозу выражают в греях (Гр) (1 Гр = 1 Дж/кг), внесистемной единицей измерения поглощенной дозы является рад (1 рад = 10-2 грей);
эквивалентная доза. Поскольку поражающее действие ионизирующего излучения зависит не только от поглощенной дозы, но и от ионизирующей способности излучения, вводится понятие эквивалентной дозы. Для расчета эквивалентной дозы поглощенную дозу умножают на коэффициент, отражающий способность данного вида излучения повреждать ткани организма. При этом альфа-излучение считается в двадцать раз опаснее других видов излучений. В системе СИ единицей измерения эквивалентной дозы излучения служит зиверт (Зв), а внесистемной единицей является бэр (1 Зв = 100 бэр).
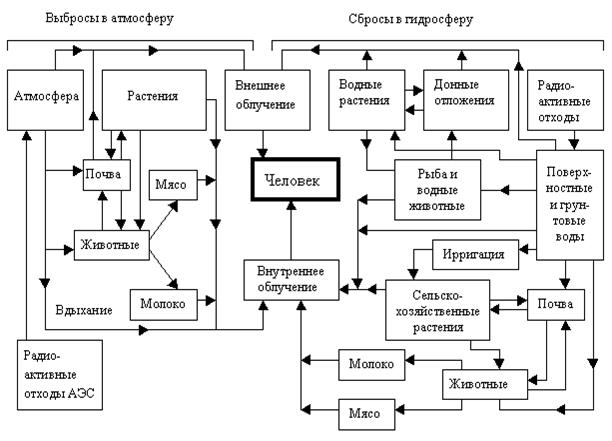
Рис. 8.2. Пути воздействия радиоактивных отходов АЭС на человека
Радиационные эффекты облучения. При воздействии на организм человека ионизирующая радиация может вызвать два вида эффектов: детерминированный и стохастический.
Детерминированные– биологические эффекты излучения, в отношении которых предполагается существование дозового порога (0,5–1 Гр), выше которого тяжесть эффекта зависит от дозы. К детерминированным эффектам относятся:
1. Острая лучевая болезнь (ОЛБ) – проявляется как при внешнем, так и при внутреннем облучении. В случае однократного равномерного внешнего фотонного облучения ОЛБ возникает при поглощенной дозе D ³ 1 Гр и подразделяется на четыре степени:
I – легкая (D = 1–2 Гр), смертельный эффект отсутствует;
II – средняя (D = 2–4 Гр), через 2–6 недель после облучения смертельный исход возможен в 20% случаев;
III – тяжелая (D = 4–6 Гр), средняя летальная доза – в течение
30 дней возможен летальный исход в 50% случаев;
IV – крайней тяжести (D > 6 Гр), абсолютно смертельная доза – в 100% случаев наступает смерть от кровоизлияний или инфекционных заболеваний вследствие потери иммунитета (при отсутствии лечения). При лечении смертельный исход может быть исключен даже при дозах около 10 Гр.
2. Хроническая лучевая болезнь формируется постепенно при длительном облучении дозами, значения которых ниже доз, вызывающих ОЛБ, но выше предельно допустимых. Последствия – лейкоз, опухоли; через
10–25 лет возможен летальный исход.
3. Локальные лучевые повреждения характеризуются длительным течением заболевания и могут приводить к лучевому ожогу и раку (некрозу) кожи, помутнению хрусталика глаза (лучевая катаракта).
Стохастические (вероятностные) эффекты – это биологические эффекты излучения, не имеющие дозового порога. Принимается, что вероятность этих эффектов пропорциональна дозе, а тяжесть их проявления от дозы не зависит. Основные стохастические эффекты:
1. Канцерогенные – злокачественные опухоли, лейкозы – злокачественные изменения кровеобразующих клеток.
2. Генетические – наследственные болезни, обусловленные генными мутациями.
Стохастические эффекты оцениваются значениями эффективной (эквивалентной) дозы. Имеют длительный латентный (скрытый) период, измеряемый десятками лет после облучения, трудно обнаруживаемы.
Нормирование радиации. Исходя из возможных последствий влияния ионизирующих излучений на организм, установлены следующие категории облучаемых лиц: А – персонал; Б – ограниченная часть населения;
В – население области, края, республики, страны.
Для указанных категорий облучаемых лиц приняты основные дозовые пределы – предел годовой эффективной или эквивалентной дозы – величина дозы, которая не должна превышаться за год (табл. 8.5) [21]. Для
группы Б эта величина составляет 25% от величины дозы для группы группы А.
Допустимые уровни мощности дозы при внешнем облучении всего тела от техногенных источников ионизирующих излучений:
помещения постоянного пребывания персонала – 10 мкГр/ч;
жилые помещения и население – 0,1 мкГр/ч.
Таблица 8.5. Основные пределы доз (НРБ-99)
| Нормируемые величины | Группа А | Население |
| Эффективная доза | 20 мЗв в год в среднем за любые последовательные 5 лет, но не более 50 мЗв в год | 1 мЗв в год в среднем за любые последовательные 5 лет, но не более 5 мЗв в год |
| Эквивалентная доза: хрусталик | 150 мЗв | 15 мЗв |
| глаза | 500 мЗв | 50 мЗв |
| кожа | 500 мЗв | 50 мЗв |
| кисти и стопы | 500 мЗв | 50 мЗв |
Нормами радиационной безопасности лимитируется годовое поступление радиоактивного вещества в организм человека. Зная объем вдыхаемого человеком воздуха в год и считая, что количество радиоактивного вещества поступает в организм через органы дыхания, можно определить среднегодовую допустимую концентрацию радиоактивного вещества в воздухе (ДК). ДК – это отношение предельно допустимого поступления радиоактивного вещества к объему воздуха, с которым оно поступает в организм человека в течение года.
В реальных условиях различные органы или ткани человека облучаются неодинаково. Особенно это проявляется при попадании радиоактивных веществ внутрь организма, поскольку различные радионуклиды по-разному распределяются по органам и тканям человека. Учитывая эти обстоятельства, а также неодинаковую радиочувствительность различных органов и тканей человека, нормирование радиационного фактора ведется для трех групп критических органов. Критический орган – ткань или часть тела, облучение которой в данных условиях неравномерного облучения может причинить наибольший ущерб здоровью данного лица или потомства. К I группе критических органов относятся гонады и красный костный мозг; ко II группе – мышцы, легкие, щитовидная железа, желудочно-кишечный тракт, хрусталик глаза и другие органы, за исключением относящихся к I и III группам. III группа – кожный покров, костная ткань, кисти рук, предплечья, голени и стопы.
В зависимости от группы критических органов в качестве основных дозовых пределов регламентирована предельно допустимая доза (ПДД).
Предельно допустимая доза (ПДД) – наибольшая индивидуальная доза за год, которая при равномерном воздействии в течение 50 лет не вызовет в состоянии здоровья персонала неблагоприятные изменения, обнаруживаемые современными методами.
При облучении всего тела и для I группы критических органов установлено значение ПДД 50 мЗв (5 бэр) в год. Для II и III групп критических органов ПДД равна 150 и 300 мЗв (15 и 30 бэр) в год соответственно.
Для лиц категории Б, к которым относятся не только взрослые, но и дети, а также беременные женщины, установленный предел дозы (ПД) в
10 раз меньше ПДД для категории А и равен 5 мЗв (0,5 бэр) в год при облучении всего тела и I группы критических органов и 15 и 30 мЗв (1,5 и
30 бэр) в год для критических органов II и III групп соответственно.
Облучение всего населения, то есть лиц категории В, не регламентируется.
Таким образом, для обеспечения радиационной безопасности населения необходимо:
создание условий жизнедеятельности людей, отвечающих требованиям действующих норм и правил радиационной безопасности;
установка квот на облучение от разных источников излучения;
организация радиационного контроля;
эффективность планирования и проведения мероприятий по радиационной защите в нормальных условиях и в случае радиационной аварии;
организация системы информации о радиационной обстановке [18].
ГЛАВА 9. Общие принципы диагностики и лечения
острых отравлений
Отравлением, или интоксикациейназывается патологическое состояние, развивающееся вследствие взаимодействия живого организма и яда.
Острые отравления химической этиологии составляют в настоящее время около 20% так называемых экологических болезней, связанных с воздействием вредных факторов окружающей среды – физических (травматические болезни), биологических (инфекционные болезни), химических (отравления). Они составляют вторую после сердечно-сосудистых заболеваний причину смертности населения в большинстве развитых стран мира. Среди смертельных отравлений на первом месте находятся отравления алкоголем и его суррогатами (более 60% случаев), затем лекарствами и наркотиками (около 15%), угарным газом (10%), прижигающими жидкостями (5%) и другими токсическими веществами.
Причины острых отравлений делятся на две основные категории:
1. Случайные (около 60%):
производственные;
бытовые (самолечение, передозировка лекарств, алкогольная или наркотическая интоксикация, грибные отравления);
медицинские ошибки.
2. Преднамеренные:
криминальные (с целью убийства или как способ приведения в беспомощное состояние);
суицидальные (около 90%).
Диагностика острых отравлений. Диагностика отравлений направлена на установление химической этиологии заболеваний, развивающихся в результате воздействия чужеродных токсических веществ, и состоит из трех основных видов диагностических мероприятий:
1) клинической диагностики, основанной на данных анамнеза, результатах осмотра места происшествия и изучении клинической картины заболевания для выделения специфических симптомов отравления. Проводится врачом, оказывающим больному помощь на догоспитальном этапе или в стационаре;
2) лабораторной токсикологической диагностики, направленной на качественное и количественное определение (идентификацию) токсических веществ в биологических средах организма (крови, моче, спинномозговой жидкости и др.). Проводится химиками-экспертами;
3) патоморфологической диагностики, направленной на выявление специфических посмертных признаков отравления какими-либо токсическими веществами. Проводится судебно-медицинскими экспертами.
Основные методы детоксикации организма при острых отравлениях.Лечебные мероприятия, направленные на прекращение воздействия токсичных веществ и их удаление из организма подразделяются на следующие группы: методы усиления естественных процессов очищения, методы искусственной детоксикации и методы антидотной детоксикации.
Методы усиления естественной детоксикации организма:
1. Очищение желудочно-кишечного тракта:
рвотные средства (апоморфин);
промывание желудка (простое, зондовое);
промывание кишечника (зондовый лаваж, клизма);
слабительные средства (солевые, масленые, растительные);
электростимуляция кишечника (KCl + питуитрин).
2. Метод форсированного диуреза – применяется при острых отравлениях водорастворимыми и неионизированными ядами. Любая методика форсированного диуреза предусматривает предварительную водную нагрузку, введение диуретика и заместительную инфузию растворов электролитов.
водоэлектролитная нагрузка (пероральная, парентеральная);
осмотический диурез (мочевина, маннитол, сорбитол);
салуретический диурез (лазикс).
3. Лечебная гипервентиляция легких (ингаляция карбогена) – применяют при острых отравлениях токсическими веществами, которые в значительной степени удаляются из организма через легкие. Операцию проводят с помощью ингаляции карбогена или подключения больного к аппарату ИВЛ (искусственная вентиляция легких).
4. Лечебная гипер- и гипотермия. Гипертермия – повышение температуры тела как защитная реакция организма против чужеродных антигенов. Гипотермия – искусственное охлаждение тела как средство снижения интенсивности метаболических процессов и повышения устойчивости к гипоксии.
5. Фармакологическое регулирование биотрансформации лекарств (гипохлорит натрия) – индукция активности ферментов главным образом в микросомах печени, ответственных за метаболизм токсических соединений, или снижение, то есть ингибиция этих ферментов, влекущая за собой замедление данного метаболизма. Для максимального сокращения токсикогенной стадии отравлений метод химиогеотерапии гипохлоритом натрия обычно сочетают с последующим проведением методов искусственной детоксикации (гемосорбция, гемодиализ).
Методы искусственной детоксикации организма. Все рассмотренные выше детоксикационные методы мало эффективны при тяжелых формах отравлений, сопровождающихся нарушениями общего гомеостаза. В этих случаях лучшие результаты дают методы искусственной детоксикации:
1. Сорбционные – поглощение молекул газов, паров или растворов поверхностью твердого тела или жидкости. В основном используют физическую адсорбцию, при которой молекулы адсорбата сохраняют свою структуру. При химической адсорбции образуется новое химическое соединение. Различают биологические, растительные и искусственные сорбенты:
экстракорпоральные методы: гемо-, плазмо- и лимфосорбция – адсорбция чужеродных веществ крови на поверхности твердой фазы, то есть перфузия крови через сорбенты (активированный уголь). Операцию проводят с помощью детоксикатора – передвижного аппарата с перфузионным насосом по крови и набором колонок-детоксикаторов, содержащих гемосорбент;
аппликационная сорбция (аллогенные клетки печени);
интракорпоральная: энтеросорбция – наиболее доступный метод искусственной детоксикации, в качестве сорбента обычно используют активированный уголь, который вводят в желудок сразу после промывания через тот же зонд;
2. Диализ и фильтрация крови (лимфы, плазмы) – удаление низкомолекулярных веществ из растворов коллоидных и высокомолекулярных веществ, основанное на свойствах полупроницаемых мембран пропускать низкомолекулярные вещества и ионы, соответствующие по размерам их порам (до 50 нм), и задерживать коллоидные частицы и макромолекулы. Как полупроницаемые мембраны используются естественные мембраны (серозные оболочки) и искусственные синтетические мембраны (целлофан, купрофан и др.). Существует большое разнообразие методов для проведения диализа:
экстракорпоральные методы: гемо-, плазмо- и лимфодиализ;
ультрафильтрация, гемофильтрация, гемодиафильтрация;
интракорпоральные методы: перитонеальный диализ, кишечный диализ, клеточный диализ.
3. Аферетические – разведение и замещение крови (лимфы).: процесс замещения биологической жидкости, содержащей токсичные вещества, другой подобной ей биологической жидкостью или искусственной средой с целью выведения токсических веществ из организма. Наибольшее распространение получило кровопускание, как средство снижения концентрации токсических веществ в организме, с последующей компенсацией выпущенного объема донорской кровью (операция замещения крови):
плазмозамещающими препаратами (гемодез);
гемаферезом (плазмаферез);
лимфаферезом, перфузией лимфатической системы.
4. Физио- и химиогемотерапия:
ультрафиолетовое облучение крови;
лазерное облучение крови;
магнитная обработка крови;
электрохимическое окисление крови (гипохлорит натрия);
озоногемотерапия.
Антидотная детоксикация. Уже на рубеже XVIII–XIX веков развитие химии и биологии позволяло предложить для лечебных целей ряд химических препаратов, антидотное действие которых было связано с обезвреживанием токсичных веществ неорганического ряда (кислоты, щелочи и др.) путем реакции химической нейтрализации и преобразования их в нерастворимые соли, а органических веществ (алкалоиды, белковые токсины и др.) – с помощью процесса адсорбции.
Антидотом (от лат. Antidotum – даваемое против) называется лекарство, применяемое при лечении отравлений и способствующее обезвреживанию яда или предупреждению и устранению вызываемого им токсического эффекта. По сути, любой антидот – химическое вещество, предназначенное для введения до, в момент или после поступления токсиканта в организм, то есть коергист, обязательным свойством которого должен быть антагонизм к яду. Антагонизм никогда не бывает абсолютным, и его выраженность существенным образом зависит от последовательности введения веществ, их доз, времени между введениями.
Обычно выделяют следующие механизмы антагонистических отношений двух химических веществ (табл. 9.1):
Антидоты с химическим антагонизмом непосредственно связываются с токсикантами. При этом осуществляется нейтрализация свободно циркулирующего яда.
Биохимические антагонисты вытесняют токсикант из его связи с биомолекулами-мишенями и восстанавливают нормальное течение биохимических процессов в организме. Это взаимодействие приводит к нарушению свойств молекул и утрате ими специфической физиологической активности. Химические вещества, разрушающие связь «мишень – токсикант» и восстанавливающие тем самым физиологическую активность биологически значимых молекул (молекулярных комплексов) или препятствующие образованию подобной связи, могут использоваться в качестве антидотов.
Данный вид антагонизма лежит в основе антидотной активности кислорода при отравлении оксидом углерода, реактиваторов холинэстеразы и обратимых ингибиторов холинэстеразы при отравлениях фосфорорганическими соединениями, пиридоксальфосфата при отравлениях гидразином и его производными.
Физиологические антидоты, как правило, нормализуют проведение нервных импульсов в синапсах (связь, контакт, соединение клеток), подвергшихся атаке токсикантов. Механизмы действия физиологических антидотов определяются их фармакологической активностью. Эти антидоты нужно применять в достаточно больших дозах, создающих лечебную концентрацию, способную нивелировать действие токсической дозы лекарственных средств.
В качестве физиологических антидотов в настоящее время используют: атропин и другие холинолитики, галантамин, пиридостигмин, аминостигмин, бензодиазепины, барбитураты, флюмазенил, налоксон [22].
Таблица 9.1. Классификация противоядий
| Антидоты | Токсические вещества |
| 1 | 2 |
| 1. Химические (токсикотропные) противоядия: а) контактного действия | Перманганат калия Все, кроме металлов |
| энтеросорбенты – СКТ, СКН (все кроме цианидов, Fe, Li), карболен, микросорб и пр. | |
| аскорбиновая кислота | |
| энтеродез |
Окончание табл. 9.1
| 1 | 2 |
| б) парентерального действия | Гепарин |
| протамин-сульфат | |
| в) комплексоны | |
| тетацин-кальций | Свинец |
| купренил | Медь |
| дисфераль | Железо |
| 2. Биохимические (токсикокинетические противоядия): метиленовая синь, амилнитрит | Цианиды, нитрит натрия |
| витамин В6 | Изониазиды (тубазид и др.) |
| унитиол, тиосульфат натрия | Ртуть |
| этиловый спирт | Метанол, этиленгликоль |
| оксимы (диэксим) | Фосфорорганические инсектициды |
| – цитохром С | Окись углерода |
| 3. Фармакологические антагонисты: атропин | Пилокарпин, фосфорорганические инсектициды |
| налоксон (нарканти) | Производные опия |
| анексат | Производные бензодиазепина |
| 4. Антитоксическая иммунотерапия противозмеиная сыворотка | Змеиный яд |
| противокаракуртовая сыворотка | Яд каракурта |
Модификаторы метаболизма препятствуют превращению ксенобиотика в высокотоксичные метаболиты либо ускоряют биодетоксикацию вещества. В качестве средств, модифицирующих метаболизм, могут быть применены препараты, изменяющие активность ферментов первой и второй фаз метаболизма: индукторы и ингибиторы микросомальных ферментов, активаторы процессов конъюгации, а также вещества, модифицирующие активность достаточно специфично действующих энзимов, и потому активные лишь при интоксикациях вполне конкретными веществами [17].
[1] in situ – термин означает рассмотрение явления именно в месте, где оно происходит, то есть без перемещения в специальную среду.
[2] кДа – килоДальто́н. Дальто́н — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода 12C и равна 1/12 массы этого нуклида.
[3] in vitro – термин обозначает технологию выполнения экспериментов, когда опыты проводятся в пробирках либо, в более общем смысле, вне живого организма.
Дата добавления: 2016-02-13; просмотров: 1360;
