7 страница. агенты селективного действия, вызывающие опухоли определенных локализаций (винилхлорид);
агенты селективного действия, вызывающие опухоли определенных локализаций (винилхлорид);
вещества множественного действия, индуцирующие опухоли различной морфологической структуры разных органов и тканей (2-ацетиламинофлуорен).
Подобное подразделение также достаточно условно, поскольку в зависимости от метода введения в организм, экспозиции, объекта исследования, дозы введенного агента может существенно меняться локализация опухолей и даже их морфологическая структура [13].
Наибольшим признанием пользуется классификация химических соединений по степени доказанности их канцерогенной опасности:
1. Вещества (факторы), для которых имеются безусловные доказательства опасности возникновения опухолей у человека. В перечне этой группы 63 наименования. Например, радиоактивные вещества, бензол, мышьяк и его соединения, алкогольные напитки, табак (табачный дым).
2. Вещества, которые с меньшей степенью доказанности обладают канцерогенностью. В этой группе имеются две подгруппы: 2А (59 факторов)–агенты с весьма высокой степенью доказанности, то есть они (вещества) имеют ограниченные для человека и убедительные для животных свидетельства канцерогенности (бенз(а)пирен, формальдегид и др.);
2Б (228 факторов)– вещества, вероятно вызывающие рак у человека, то есть имеющие ограниченные или неадекватные доказательства канцерогенности для человека при отсутствии убедительных свидетельств в опытах на животных (акрилонитрил, кобальт и др.).
3. Вещества (475 наименований), которые нельзя достоверно классифицировать как канцерогенные (катехол, хлордан, фуразолидон, клофибрат и др.).
4. Вещества, для которых существуют убедительные доказательства отсутствия канцерогенного действия (капролактам).
Эта классификация не является классификацией опасности и носит лишь информационный, рекомендательный характер, не являясь обязательной для законодательных мер, служб здравоохранения и охраны окружающей среды [44].
Наиболее часто химические канцерогенные факторы классифицируют согласно их структуре и выделяют следующие группы:
1) полициклические ароматические углеводороды и гетероциклические соединения;
2) ароматические азотсоединения;
3) ароматические аминосоединения;
4) нитрозосоединения;
5) металлы и металлоиды;
6) алкирующие канцерогенные агенты.
Эта классификация относительно удобна, но поверхностна, поскольку, с одной стороны, далеко не все представители указанных групп канцерогенны, с другой – существуют агенты иной химической структуры, которые способны вызвать рак.
Регламентирование химических канцерогенов и количественная оценка канцерогенной опасности.Канцерогенный эффект, формирующийся в результате воздействия химического канцерогенного агента, представляет собой объективный показатель, учитываемый в альтернативной форме. Статистическая оценка эффекта основывается на подсчете числа животных с опухолями. Вероятность возникновения опухоли P определяется отношением числа случаев возникновения опухолей m при воздействии дозы d к числу всех возможных случаев n, то есть
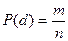 .
.
Указанный подход используется как при пожизненном наблюдении за гибелью животных, так и при промежуточных расчетах для каждой забиваемой серии.
При расчете частоты опухолей для фиксированного срока забоя применяют формулу
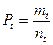 ,
,
где Pt – вероятность возникновения опухолей на срок забоя t; nt – число забитых животных на срок t; mt – число животных с опухолью на срок t.
В тех случаях, когда у животных возникают не одна, а несколько опухолей, используют коэффициент множественности Rt, представляющий собой среднее число опухолей на одно животное, который рассчитывается по формуле
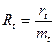 ,
,
где Rt – общее количество опухолей у животных в исследуемой группе за время наблюдения t; mt – количество животных с опухолями за это же время.
Время появления опухолей обратно пропорционально разовой ежедневной дозе, то есть
d tn = k,
где d – ежедневная доза; t – латентный период; k – постоянная величина;
n – показатель степени, n >1.
Исходя из данного соотношения, основными критериями канцерогенного воздействия принято считать дозу канцерогенного вещества и его экспозицию. Вероятностный параметр оценки – эффективная бластомогенная доза БД50, представляющая собой суммарное количество вещества, способное вызвать опухоль у 50% подопытных животных в группе при заданной экспозиции за всю продолжительность жизни. Расчет БД50 и ее доверительных границ производится методами матстатистики.
Время развития опухоли (латентный период) X представляет собой частное от деления суммы всех латентных периодов ∑xi на общее число животных с опухолями n:
X = ∑xi/ n.
Неизученность механизмов канцерогенеза и отсутствие единой гипотезы возникновения рака не позволяют в настоящее время принять единую систему нормирования химических канцерогенов и оценки риска [13]. Основой нормирования химических канцерогенов является построение зависимости «доза – время – эффект», где под эффектом подразумевается вероятность развития опухолей.
Наиболее часто используемый для нормирования канцерогенов подход, называемый методом доверительных границ, основан на выявлении дозы (концентрации) вещества, дающей канцерогенный эффект, который отличается от спонтанного и с определенным уровнем значимости может быть перенесен на популяцию (рис. 8.1).

Классифицирование канцерогенов на основе показателей опасности может быть осуществлено по степени вероятности возникновения бластомогенного эффекта, учитываемого на основе объективных количественных параметров канцерогенеза. Так, располагая вероятностными значениями эффективной бластомогенной дозы БД50 и среднего латентного периода, можно провести количественную оценку опасности вещества, обладающего бластомогенной активностью:
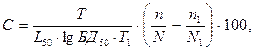
где C – показатель бластомогенной опасности; T – число наименований первично пораженных органов у животных подопытной группы;
L50 – средний латентный период у животных подопытной группы;
БД50 – эффективная бластомогенная доза канцерогена в подопытной группе; T1 – число наименований первично пораженных органов у животных контрольной группы; n – число подопытных животных с опухолями;
N – число подопытных животных, доживших до первой опухоли; n1 – число контрольных животных с опухолями; N1 – число контрольных животных, доживших до первой опухоли.
Распределение классов опасности канцерогенов по показателю С приведено в табл. 8.1.
Таблица 8.1. Классы опасности химических канцерогенов
| Канцерогены | Класс опасности | С |
| Чрезвычайно опасные | > 3 | |
| Высокоопасные | 2,99–2 | |
| Умеренно опасные | 1,99–1 | |
| Малоопасные | <1 |
Эта классификация может служить основой для профилактических мероприятий при производстве и применении веществ, а также регламентирования в объектах окружающей среды.
Обязательным условием классифицирования является проведение экспериментальных исследований на животных в соответствии с существующими нормативно-методическими документами.
Опыт нормирования химических канцерогенов позволил разработать ориентировочные значения ПДК химических канцерогенов в различных средах в зависимости от классов опасности (табл. 8.2) [22].
Таблица 8.2. Ориентировочные значения ПДК в зависимости от класса бластомогенной опасности
| Класс опасности | ПДКр.з, мг/м3 | ПДКа.в., мг/100м3 | ПДКв.в., мг/дм3 |
| Чрезвычайно опасные | 0,0001 | 0,0001 | 0,000 005 |
| Высокоопасные | 0,001 | 0,001 | 0,000 05 |
| Умеренно опасные | 0,01 | 0,01 | 0,0005 |
| Малоопасные | 0,1 | 0,1 | 0,005 |
8.2. Тиоловые яды
К тиоловым ядам относятся химические вещества, способные блокировать сульфгидрильные (SH-) группы белков и тем самым нарушать обменные процессы в организме, многие элементы неорганической и органической природы, прежде всего мышьяк и тяжелые металлы (кадмий, ртуть, свинец), а также медь, железо, кобальт, цинк, марганец, молибден, хром, ванадий, никель.
Тиоловые яды используются во всех сферах хозяйственной деятельности человека как в чистом виде, так и в сплавах, огромном количестве неорганических и органических соединений. Широкое распространение указанных элементов и их соединений в природе, постоянно возрастающее антропогенное загрязнение ими окружающей среды, которое приняло глобальный характер, явились основой интенсивного изучения металлов в экологической токсикологии.
Следует сказать, что большая часть металлов относится к категории биоактивных и необходимых для нормальной жизнедеятельности организма. Их воздействие вызывает негативные реакции, изменение физиологических функций и метаболизма не только при избытке, но и при недостатке микроэлементов в организме. Ионы металлов в зависимости от их поведения в живых системах распределяют на необходимые, инертные и токсичные. Однако это разделение условно, поскольку в зависимости от концентрации и времени контакта металл может действовать по каждому из данных типов.
Кроме того, отличительной особенностью тиоловых ядов является их выраженная способность к материальной кумуляции в биообъектах с возможными признаками токсического действия после более или менее продолжительного латентного периода.
Механизм токсического действия.Ведущим механизмом токсического действия тяжелых металлов признается угнетение ими многих ферментных систем в результате блокирования сульфгидрильных и других функциональных групп в активных центрах и иных биологически важных участках белковых молекул. В результате потери протеидами многих физико-химических и биологических свойств нарушается белковый, углеводный и жировой обмен, разрушается структура клеточных оболочек, что приводит к выходу из клетки калия и проникновению в нее натрия и воды.
Не менее важным элементом токсического действия тиоловых ядов является нарушение ими проницаемости клеточных мембран.
Соединения тяжелых металлов и мышьяка избирательно токсичны в основном для специфического эпителия почек, печени, кишечника, эритроцитов и нервных клеток, где наблюдается повышенная концентрация этих веществ.
Токсикокинетика и токсикодинамика тиоловых ядов.Соединения тяжелых металлов могут поступать в организм пероральным, ингаляционным путем, а также через кожу и слизистые оболочки, при парентеральном введении.
При пероральном отравлении эти соединения всасываются в ионизированном виде, чему способствует наличие хлоридов в желудочном соке и щелочная реакция кишечного сока. Основной участок всасывания – двенадцатиперстная кишка и начальный отдел тощей кишки. В крови тиоловые яды циркулируют в виде ионов в комплексе с аминокислотами, жирными кислотами. Ведущую роль в транспорте тяжелых металлов играют белки, образующие с ними прочную связь.
Соединения тяжелых металлов распределяются и депонируются в течение нескольких месяцев практически во всех органах. Эти вещества накапливаются в высоких концентрациях и долго остаются в почках и печени, что объясняется высоким содержанием в почечной и печеночной ткани особого белка металлобионина, богатого тиоловыми группами.
Тиоловые яды выделяются через почки, печень (с желчью), слизистую оболочку желудка и кишечника, потовые и слюнные железы, что сопровождается, как правило, поражением выделительных аппаратов этих органов. Существует тесная связь между токсичностью металла и его физико-химическими свойствами (табл. 8.3). Токсичность возрастает с увеличением атомной массы металла, зависит от способности к диссоциации их комплексов с белками, растворимости соединений в воде и липидах. Более медленная ионизация делает окислы менее токсичными, чем соли тех же металлов.
Таблица 8.3. Основные биогеохимические свойства тяжелых металлов
| Свойства металла | Cd | Co | Cu | Hg | Ni | Pb | Zn |
| 1. Биохимическая активность | В | В | В | В | В | В | В |
| 2. Токсичность | В | У | У | В | У | В | В |
| 3. Канцерогенность | – | В | – | – | В | – | – |
| 4. Минеральная форма распространения | В | В | Н | В | Н | В | Н |
| 5. Органическая форма распространения | В | В | В | В | В | В | В |
| 6. Подвижность | В | Н | У | В | Н | В | У |
| 7. Комплексообразующая 8. способность | У | Н | В | У | Н | Н | В |
| 9. Растворимость | В | Н | В | В | Н | В | В |
| 10. Время жизни | Н | В | В | Н | В | Н | В |
Примечание. В – высокая; У– умеренная; Н – низкая.
Острые отравления.Острые отравления тяжелыми металлами профессионального характера, благодаря комплексу эффективных превентивных мер, чрезвычайно редки. Они могут возникать при аварийных ситуациях, несчастных случаях на производстве и в быту (случайные отравления), носить суицидный (попытка к самоубийству) либо криминальный
(с целью убийства) характер.
Желудочно-кишечные поражения наблюдаются у 97,3% больных и обусловлены как прижигающим действием данных соединений, так и их выделением слизистыми оболочками рта и толстого кишечника (выделительный стоматит и колит). У больных появляются металлический вкус во рту, тошнота, боль при глотании, по ходу пищевода, боль в животе. Кроме того, при обследовании у больных отмечаются рвота, гиперемия зева и задней стенки глотки, боль при пальпации шейного отдела пищевода, по ходу пищевода. Токсическое поражение крови сопровождается гемолизом и анемией. Гемолиз типичен для мышьяковистого водорода и соединений меди. Причиной анемии является токсическое действие тиоловых ядов на костный мозг.
Ингаляционные отравления парами ртути и органическими соединениями тяжелых металлов вызывают психоневрологические симптомы: возбудимость, бессонницу, раздражительность, затруднение глотания, нарушение тазовых функций, депрессию, дезориентацию и т. д.
Для чрезкожного отравления ртутной мазью характерен токсический дерматит (зудящая сыпь, расчесы, лихорадка).
Хронические отравления.Типичные формы как острых, так и хронических интоксикаций, характерные для воздействия высоких концентраций тиоловых ядов, практически не встречаются. Клинические проявления хронических интоксикаций тяжелыми металлами имеют много общего, поскольку они обладают выраженным нейротоксическим действием. Они существенно влияют на эндокринную систему, сердце, сосуды, печень, почки, а также процессы обмена, в частности белкового, воздействуют на функциональное состояние половой сферы мужского и женского организма, его репродуктивные функции [22].
8.3. Действие ксенобиотиков на систему крови
Среди специфических проявлений повреждающего действия химических веществ на организм значительное место принадлежит поражениям системы крови. Возникшее в связи с этим понятие «яды крови» достаточно условно, учитывая, что последние нередко обладают и другими специфическими видами биологической активности.
Выделяют три разновидности веществ, вызывающих токсическое поражение крови и отличающихся причинными особенностями пускового механизма действия:
вещества, вызывающие заболевания, связанные с изменением пигмента крови (оксид углерода, нитро-, аминопроизводные бензола, нитраты и нитриты и др.);
вещества, вызывающие первичный гемолиз (мышьяковистый водород, фенилгидразин и др.);
вещества, вызывающие первичное угнетение гемопоэза (бензол и его производные).
Токсическое поражение пигмента крови.Проявления гемотоксического действия химических веществ за счет первичного воздействия на пигмент крови разняться по характеру в зависимости от генеза нарушений.
Гемоглобин – это сложный белок, состоящий из собственно белка –глобина – и простетической группы – гемма. Гемма представляет собой комплекс закисного (двухвалентного) железа с протопорфирином, то есть железопорфирином [20]. Прежде чем перейти к описанию поражений крови химической этиологии, связанных с воздействием на пигмент крови, следует сказать о физиологической роли гемоглобина в организме. Физиологическая роль гемоглобина в организме состоит в его непосредственном участии в транспорте кислорода от капилляров легочных альвеол к капиллярам всех органов и тканей. Механизм переноса кислорода гемоглобином, содержащимся в эритроцитах, заключается в его способности обратимо присоединять кислород. Под обратимым присоединением кислорода понимают способность гемоглобина образовывать с кислородом оксигемоглобин согласно реакции Hb + O2 → HbO2.
Карбоксигемоглобинемия. Классическим примером повреждающего действия на кровь с нарушением дыхательной функции, обусловленным инактивацией кровяного пигмента – гемоглобина, служит образование карбоксигемоглобина (HbCO) под влиянием оксида углерода. Превращение гемоглобина в HbCO приводит к изменению спектральных характеристик крови. Карбоксигемоглобин образуется в результате взаимодействия оксида углерода (CO) с железом гемоглобина, который утрачивает способность переносить кислород и вызывает развитие гемической гипоксии. Наблюдения показывают, что при содержании 10% HbCO в крови отмечается лишь одышка при физическом напряжении, при 40–50% – разные признаки интоксикации: головная боль, помрачнение сознания вплоть до его потери, а содержание HbCO от 60% и выше приводит к летальному исходу, что зависит от чувствительности к CO.
Кроме того, доказано, что CO действует на многие биологически активные системы организма, содержащие железо: миоглобин, цитохромсодержащие дыхательные ферменты.
Как при острых, так и хронических отравлениях оксидом углерода отмечаются симптомы поражения ЦНС, а также других органов и систем (сердечно-сосудистой системы, эндокринной системы, щитовидной железы и надпочечников и др.) [41].
Метгемоглобинемия. К поражениям крови за счет инактивации дыхательного пигмента крови, помимо карбоксигемоглобинемии, относятся патологические состояния, которые сопровождаются развитием метгемоглобинемии и сульфгемоглобинемии. Метгемоглобин – патологический дериват гемоглобина, в котором железо из двухвалентного переходит в окисленную трехвалентную форму, утрачивая при этом способность присоединять кислород и транспортировать его к органам и тканям, то есть нарушается дыхательная функция крови. Среди соединений, которые обладают способностью к мет- и сульфгемоглобинобразованию, выделяют амино- и нитропроизводные бензола, нитриты и нитраты, красную кровяную соль, бертолетову соль и некоторые другие вещества. Образование метгемоглобина может происходить за счет прямого окисления гемоглобина в метгемоглобин под влиянием этих веществ, а также за счет эндогенного образования метгемоглобина (в случае возрастания эндогенной перекиси водорода).
Острое токсическое действие на кровь метгемоглобинобразователей проявляется образованием цианоза (особенно на деснах, губах, ушах, кончике носа), выраженность которого пропорциональна тяжести отравления; присутствием признаков анемии (падение гемоглобина, числа эритроцитов).
Специфическим симптомом острого гемолитического состояния при отравлении метгемобразователями служит появление телец Гейнца. Между степенью анемии и интенсивностью их образования существует связь, поскольку именно они приводят к нарушению структуры эритроцитов. Эритроциты, содержащие тельца Гейнца, обречены на быстрое разрушение, являя собой пример ускоренного старения.
Отличительная особенность анемии при хроническом отравлении метгемоглобинобразователей – ее гипохромный характер сравнительно с гиперхромной анемией при остром отравлении. В остальном специфические изменения красной крови аналогичны тем, которые наблюдаются при острых поражениях.
Угнетение ксенобиотиками системы кроветворения.К этой категории относятся две разновидности повреждающего влияния на систему крови, которые отличаются патогенетическими особенностями угнетения гемопоэза.
Первая разновидность заключается в подавлении гемопоэтической активности всех ростков кроветворной ткани с развитием гипо- и апластических состояний. Моделью такого поражения крови служит интоксикация бензолом (сходные, но менее выраженные изменения вызывают хлорбензол, гексаметилендиамин, гексаметиленимин и др.). Повреждающее действие на кровь по типу бензольной гемопатии сопровождается снижением продукции клеточных элементов органами кроветворения и уменьшением количества клеток в периферической крови.
Для острого отравления бензолом характерны расстройства со стороны ЦНС, присущие веществам, обладающим наркотическим действием, к которым принадлежит и бензол. Они могут выражаться в зависимости от степени воздействия различными состояниями – от быстрой потери сознания и даже гибели до разных изменений неврологического статуса в виде общего недомогания, головной боли, тошноты.
При хроническом отравлении бензолом в первую очередь поражается система крови, главным образом кроветворные органы.
Вторая разновидность характеризуется расстройством порфиринового обмена и, как следствие этого, нарушением синтеза гемма на стадии включения железа в порфириновое кольцо (таково гемотоксическое действие свинца). Угнетающее действие свинца на синтез гемма обусловлено его влиянием на ферменты, катализирующие синтез гемма. Сущность такого влияния заключается в том, что свинец блокирует функционально активные центры ферментов: сульфгидрильные (SH-), карбоксильные и аминные группы.
При достаточной интенсивности воздействия как конечный результат токсического влияния свинца на красную кровь развивается гипохромная анемия.
Кроме того, при свинцовой интоксикации в результате многолетнего контакта со свинцом развиваются изменения белой крови в виде абсолютного снижения палочкоядерных нейтрофилов со сдвигом вправо и увеличением числа дегенеративных форм нейтрофилов, при этом уменьшается содержание ДНК и увеличивается содержание РНК в нейтрофилах [22].
8.4. Действие ксенобиотиков на процессы репродукции
Реальную угрозу репродуктивной функции женщин и здоровью детей создает широкое применение в промышленности и сельском хозяйстве различных химических веществ. Женщины и дети, как наиболее чувствительная часть населения, раньше и острее реагируют на факторы внешней среды. Результаты взаимодействия женщины с окружающей средой выражаются двумя категориями: здоровьем самой женщины и здоровьем рожденного ею ребенка, – определяющими в будущем социально-трудовой потенциал населения.
Воздействие химических веществ на репродуктивную систему приводит к возрастанию числа бесплодных браков, увеличению количества разнообразной патологии беременности и родов, числа самопроизвольных выкидышей, нарушений роста и развития детей, случаев злокачественных заболеваний и преждевременному прекращению репродуктивной функции.
При рассмотрении вопросов воздействия химических веществ на процессы репродукции необходимо объяснить значение некоторых терминов.
Репродуктивное здоровье – состояние полного физического, умственного и социального благополучия во всех вопросах, касающихся репродуктивной системы, ее функций и процессов, включая воспроизводство потомства и гармонию в психосексуальных отношениях в семье (определение ООН).
Репродуктивные токсиканты – химические, физические или биологические агенты, оказывающие вредное влияние на процессы репродукции как в экспериментальном, так и в клиническом аспекте.
Репродуктивная токсичность – вредное влияние на плодовитость, беременность или потомство, вызванное воздействием химического соединения на любого из родителей.
Эмбрио-, фетотоксичность – любой токсический эффект у эмбриона и плода, включая структурные и функциональные нарушения или постнатальные проявления таких эффектов. Эмбриотоксические эффекты могут включать врожденные уродства, нарушения роста, внутриматочную гибель и повреждение постнатальных функций.
Тератогенность – способность химического вещества вызывать структурные и функциональные дефекты в период развития организма
(у зародыша или плода).
Гонадотропное действие яда – свойство яда влиять на половые железы и систему их регуляции.
Эмбрионотропное действие яда – свойство яда влиять на эмбрион и регуляцию его развития.
Фертильность – способность к деторождению.
Для решения принципиальных вопросов охраны потомства необходим комплексный методический подход, включающий социально-гигиенические, клинико-статистические и экспериментальные исследования.
Цель гигиенических исследований – оценка факторов производственной среды (вредные химические вещества, шум, вибрация, электромагнитное излучение, неблагоприятный микроклимат и др.) и трудового процесса, продолжительность воздействия, интенсивность и т. д. Параллельно изучают социально-бытовые факторы, оценивают группу обследуемых по возрасту, стажу, проводят интервьюирование по специально разработанным анкетам и др.
При клинико-статистических исследованиях выявляют изменения репродуктивной функции работающих, анализируют критериально значимые показатели нарушений репродуктивного здоровья, которые обычно подлежат статистическому учету:
показатели материнской и детской смертности и самопроизвольные выкидыши;
показатели частоты рождения детей с врожденными пороками развития, связанные с воздействием вредных факторов окружающей среды, в том числе производственной;
показатели заболеваемости с временной нетрудоспособностью, связанные с женскими болезнями и осложнениями беременности и родов;
показатели детской заболеваемости, особенно в период до 3 лет и в период полового созревания;
показатели заболеваемости репродуктивной системы мужчин.
Основная роль в профилактике патологии репродуктивной функции отводится эксперименту, который дает основу как для прогнозирования неблагоприятных эффектов до внедрения веществ в промышленность, так и для дифференцирования этиологии повреждения репродуктивной функции, если вещество уже внедрено в производство. Задачи профилактической токсикологии – определение порогов вредного действия ядов на функцию и морфологию половых желез, развитие плода и потомства.
Меру избирательности (специфичности) действия предлагается определять по зоне специфического действия Zsp, то есть по отношению порога интегрального действия Limintegr к порогу специфического действия Limspec. Если Zsp>1, это свидетельствует об избирательном (специфическом) действии химического агента на изучаемую функцию.
Анализ результатов современных исследований, касающихся влияния неблагоприятных факторов на репродуктивную систему, показывает, что ведущим среди этих факторов является химический. Вызываемые им изменения в функциональных системах – следствие общего токсического действия вещества на организм. Однако некоторые химические соединения, не оказывая в определенных дозах влияние на общее состояние организма, могут вызывать патологические нарушения в гонадах и процессе эмбриогенеза. В этом случае принято считать, что они обладают специфическим действием на генеративную функцию [37].
Дата добавления: 2016-02-13; просмотров: 1582;
